能源短缺是人类社会面临的重大问题。甲醇是一种可再生能源,具有广泛的开发和应用前景。工业上合成甲醇的反应为:CO(g)+2H2(g) CH3OH(g);ΔH
CH3OH(g);ΔH
(1)已知,该反应在300℃,5MPa条件下能自发进行,则ΔH 0,△S 0(填“<,>或=”)。
(2)在300℃,5MPa条件下,将0.20mol的 CO与0.58mol H2的混合气体充入2L密闭容器发生反应,反应过程中甲醇的物质的量浓度随时间的变化如图所示。
①在0~2min内,以H2表示的平均反应速率为 mol·L-1·s-1 ,CO的转化率为 。
②列式计算300℃时该反应的平衡常数K= 。
③300℃时,将0.50mol CO、1.00mol H2和1.00 mol CH3OH充入容积为2L的密闭容器中,此时反应将 。
A.向正方向移动 B.向逆方向移动 C.处于平衡状态 D.无法判断
④下列措施可增加甲醇产率的是 。
A.压缩容器体积 B.将CH3OH(g)从体系中分离
C.充入He,使体系总压强增大 D.再充入0.20mol CO和0.58mol H2
(3)若其它条件不变,使反应在500℃下进行,在图中作出甲醇的物质的量浓度随时间的变化的示意图。
(共14分)甲醇是重要的化学工业基础原料和液体燃料。工业上可利用CO或CO2来生产燃料甲醇。已知甲醇制备的有关化学反应以及在不同温度下的化学反应平衡常数如下表所示:
| 化学反应 |
平衡常数 |
温度(℃) |
|
| 500 |
800 |
||
①2H2(g)+CO(g) CH3OH(g) CH3OH(g) |
K1 |
2.5 |
0.15 |
②H2(g)+CO2(g) H2O (g)+CO(g) H2O (g)+CO(g) |
K2 |
1.0 |
2.50 |
③3H2(g)+ CO2(g) CH3OH(g)+H2O (g) CH3OH(g)+H2O (g) |
K3 |
(1)反应②是(填“吸热”或“放热”)反应。
(2)某温度下反应①中H2的平衡转化率(a)与体系总压强(P)的关系如图所示。则平衡状态由A变到B时,平衡常数K(A)K(B)(填“>”、“<”或“=”)。
(3)判断反应③△H0; △S0(填“>”“=”或“<”)
在500℃、2L的密闭容器中,进行反应③,测得某时刻H2、CO2、 CH3OH、H2O的物质的量分别为6mol、2 mol、10 mol、10 mol,此时v(正)v(逆)(填“>”“=”或“<”)
(4)一定温度下,在3 L容积可变的密闭容器中发生反应②,已知c(CO)与反应时间t变化曲线Ⅰ如图所示,若在t0时刻分别改变一个条件,曲线Ⅰ变为曲线Ⅱ和曲线Ⅲ。当曲线Ⅰ变为曲线Ⅱ时,改变的条件是。当曲线Ⅰ变为曲线Ⅲ时,改变的条件是。
(5)一定条件下甲醇与一氧化碳反应可以合成乙酸。通常状况下,
将0.2 mol/L的乙酸与0.1 mol/LBa(OH)2溶液等体积混合,则混合溶液中离子浓度由大到小的顺序为
.减少污染、保护环境是全世界最热门的课题。
(1)为了减少空气中SO2的排放,常采取的措施有:
①将煤转化为清洁气体燃料。
已知:H2(g)+1/2O2(g)==H2O(g)ΔH1=-241.8 kJ·mol-1
C(s)+1/2O2(g)===CO(g)ΔH2=-110.5 kJ·mol-1
则焦炭与水蒸气反应生成CO的热化学方程式为。
②洗涤含SO2的烟气。以下物质可作洗涤剂的是(填序号):
a.Ca(OH)2 b.CaCl2c.Na2CO3 d.NaHSO3
(2)CO在催化剂作用下可以与H2反应生成甲醇:CO(g)+2H2(g) 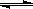 CH3OH(g)。在密闭容器中充有10 mol CO与20 mol H2,CO的平衡转化率与温度、压强的关系如右图所示。
CH3OH(g)。在密闭容器中充有10 mol CO与20 mol H2,CO的平衡转化率与温度、压强的关系如右图所示。
①M、N两点平衡状态下,容器中总物质的物质的量之比为:n(M)总:n(N)总= 。
②若M、N、Q三点的平衡常数KM、KN、KQ的大小关系为 。
(3)催化硝化法和电化学降解法可用于治理水中硝酸盐的污染。
①催化硝化法中,用H2将NO 还原为N2,一段时间后,溶液的碱性
还原为N2,一段时间后,溶液的碱性
明显增强。则该反应离子方程式为。
②电化学降解NO 的原理如图所示,电源正极为(填“a”或“b”);
的原理如图所示,电源正极为(填“a”或“b”);
若总反应为4NO3-+4H+通电5O2↑+2N2↑+2H2O,则阴极反应式为。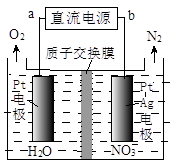
.药物Z可用于治疗哮喘、系统性红斑狼疮等,可由X(1,4-环己二酮单乙二醇缩酮)和Y(咖啡酸)为原料合成,如下图:
(1)化合物X的有种化学环境不同的氢原子。
(2)下列说法正确的是。
| A.X是芳香化合物 | B.Ni催化下Y能与5molH2加成 |
| C.Z能发生加成、取代及消去反应 | D.1mol Z最多可与5mol NaOH反应 |
(3)Y与过量的溴水反应的化学方程式为。
(4)X可以由(写名称)和M( )分子间脱水而得;一定条件下,M发生1个—OH的消去反应得到稳定化合物N(分子式为C6H8O2),则N的结构简式为(已知烯醇式不稳定,会发生分子重排,例如:
)分子间脱水而得;一定条件下,M发生1个—OH的消去反应得到稳定化合物N(分子式为C6H8O2),则N的结构简式为(已知烯醇式不稳定,会发生分子重排,例如:
 )。
)。
(5)Y也可以与环氧丙烷( )发生类似反应①的反应,其生成物的结构简式为(写一种);Y的同分异构体很多种,其中有苯环、苯环上有三个取代基(且酚羟基的位置和数目都不变)、属于酯的同分异构体有种。
)发生类似反应①的反应,其生成物的结构简式为(写一种);Y的同分异构体很多种,其中有苯环、苯环上有三个取代基(且酚羟基的位置和数目都不变)、属于酯的同分异构体有种。
(1)下图为实验室制备、收集少量HCl的装置。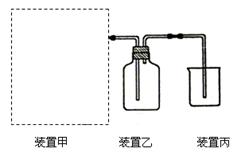
①制备HCl所用药品为浓硫酸和浓盐酸,则甲的最佳装置应选用下图中的。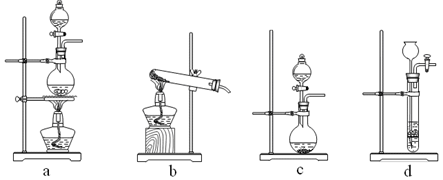
② 请解释能用浓硫酸和浓盐酸制备HCl气体的原因。
③ 装置丙用来吸收过量的HCl气体,为防止倒吸,则烧杯中应该装入水和。
(2)以下为苯的取代反应的探究实验。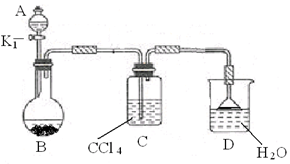
① 按上图所示的装置图连接好各仪器。
② 检验装置的气密性。
③ 在A中加入适量的苯和液溴的混合液体,在B中加入少量铁粉,塞上橡皮塞,打开K1,开始进行反应,放入适量混合液后,关闭K1。
写出B中发生反应的化学方程式。
装置C的作用是。
④ 反应结束后,用试管取少量D中的溶液,加入
(描述试剂和现象),则证明B中的取代反应已经发生。
⑤ 把B中的固液混合物体过滤,分离出液体混合物,按下图方案精制含有苯和溴的溴苯。
其中试剂为 ,操作名称为。
硫酸铅(PbSO4)广泛应用于制造铅蓄电池、白色颜料等。利用方铅矿精矿(PbS)直接制备硫酸铅粉末的流程如下:
已知:(ⅰ)PbCl2(s)+2Cl-(aq) PbCl4-(aq)△H>0
PbCl4-(aq)△H>0
(ⅱ)Ksp(PbSO4)=1.08×10-8, Ksp(PbCl2)=1.6×10-5
(ⅲ)Fe3+、Pb2+以氢氧化物形式完全沉淀时,溶液的PH值分别为3.2、7.04
(1)步骤Ⅰ中生成PbCl2和S的离子方程式,加入盐酸的另一个目的是为了控制PH值在0.5~1.0,原因是。
(2)用化学平衡移动的原理解释步骤Ⅱ中使用冰水浴的原因。
(3)写出PbCl2晶体转化为PbSO4沉淀的离子方程式。
(4)请用离子方程式解释滤液2加入H2O2可循环利用的原因,滤液3是。
(5)铅蓄电池的电解液是硫酸,充电后两个电极上沉积的 PbSO4分别转化为PbO2和Pb,充电时阴极的电极反应式为。