如图所示装置,室温下密闭容器内分别充入空气和H2.O2的混合气体在可移动的活塞两边,在标准状况下若将H2.O2的混合气体点燃引爆,活塞先左弹,恢复原温度后,活塞右滑停留于容器的中央,则原来H2.O2的体积比最接近于 ( )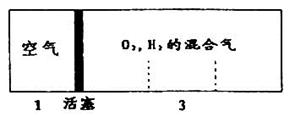
①2:7 ②5:4 ③4:5 ④7:2
| A.①② | B.②④ | C.③④ | D.①③ |
实验中的下列操作正确的是()
| A.取Na2CO3溶液,发现取量过多,为了不浪费,又把过量的试剂倒回试剂瓶中。 |
| B.将剩余的金属钠放回原盛放金属钠的试剂瓶中。 |
| C.用蒸发方法使NaCl 从溶液中析出时,应将蒸发皿中NaCl 溶液全部蒸干才停止加热。 |
| D.用浓硫酸配制一定物质的量浓度的稀硫酸时,浓硫酸溶于水后,应冷却至室温才能转移到容量瓶中 |
下列物质中属于氧化物的是()
| A.O2 | B.Na2O | C.NaClO | D.FeSO4 |
下列反应都有沉淀生成,其中属于氧化还原反应的是()
| A.Na2SO4+BaCl2===2NaCl+BaSO4↓ | B.4Fe(OH)2+O2+2H2O="=" 4Fe(OH)3↓ |
| C.FeCl3+3KOH===Fe(OH)3↓+3KCl | D.CuCl2+2NaOH===Cu(OH)2↓+2NaCl |
新型净水剂铁酸钠( )中,铁元素的化合价是()
)中,铁元素的化合价是()
| A.+2 | B.+3 | C.+5 | D.+6 |
关于在Na与H2O的反应现象描述不正确的是()
| A.Na很快融化成为小球 | B.反应时发出“嘶嘶”的响声 |
| C.Na很快沉入水底 | D.滴有酚酞的水溶液最终变为红色 |