某温度下,在一个2L的密闭容器中,加入4molA和2molB进行如下反应:
3A(g)+2B(g)  4C(s) +2D(g)反应一段时间后达到平衡,测得生成1.6molC。则下列说法正确的是
4C(s) +2D(g)反应一段时间后达到平衡,测得生成1.6molC。则下列说法正确的是
A.该反应的化学平衡常数表达式是K=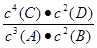
B.增加B,平衡向右移动,B的平衡转化率增大
C.此时,B的平衡转化率是40%
D.增大该体系的压强,平衡向右移动,化学平衡常数增大
已知下列热化学方程式:
(1)CH3COOH(l)+2O2(g)==2CO2(g)+2H2O(l) ΔH1=-870.3 kJ·mol-1
(2)C(s)+O2(g)===CO2(g) ΔH2=-393.5 kJ·mol-1
(3)H2(g)+O2(g)===H2O(l)ΔH3=-285.8 kJ·mol-1,
则反应2C(s)+2H2(g)+O2(g)===CH3COOH(l)的焓变ΔH为( )
| A.488.3 kJ·mol-1 | B.-244.15 kJ·mol-1 |
| C.244.15 kJ·mol-1 | D.-488.3 kJ·mol-1 |
一定量的混合气体,在密闭容器中发生如下反应:xA(g) + yB(g)  zC(g),达到平衡后测得A气体的浓度为1mol·L-1,当恒温下将密闭容器的容积扩大到2倍再达到平衡后,测得A的浓度为0.7mol·L-1,则下列叙述正确的是〔〕
zC(g),达到平衡后测得A气体的浓度为1mol·L-1,当恒温下将密闭容器的容积扩大到2倍再达到平衡后,测得A的浓度为0.7mol·L-1,则下列叙述正确的是〔〕
| A.平衡向正反应方向移动 | B.x + y = z |
C.C的体积分数升高 |
D.B的转化率降低 |
反应A(g)+3B(g)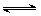 2C(g)△H﹤0达到平衡后,将气体混合
2C(g)△H﹤0达到平衡后,将气体混合 物的温度降低,下列叙述正确的是()
物的温度降低,下列叙述正确的是()
| A.正反应速率增大,逆反应速率变小,平衡向正反应方向移动 |
B.正反应速率变小,逆反应速率增大,平衡向逆反应方向 移动 移动 |
| C.正反应速率和逆反应速率都变小,平衡向正反应方向移动 |
| D.正反应速率和逆反应速率都变小,平衡向逆反应方向移动 |
有一处于平衡状态的反应A(g) + 3B(g)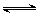 2C(g)△H<0,为了使平衡向生成
2C(g)△H<0,为了使平衡向生成 C的方向移动,应选择的条件是〔〕
C的方向移动,应选择的条件是〔〕
①升高温度②降低温度③ 增大压强④降低压强⑤加入催化剂⑥分离出C
A①③⑤ B②③⑤ C②③⑥D②④⑥
工业上氧化二氧化硫制取三氧化硫反应的化学方程式为:2SO2+O2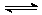 2SO3
2SO3
正反应放热,为了提高二氧化硫的转化率,下 列措施可行的是()
列措施可行的是()
A.增大氧气的物质的量 |
B.减小氧气的物质的量 |
| C.增大二氧化硫的物质的量 | D.升高温度 |