在一密闭容器中充入一定量的N2和H2,经测定反应开始后的2s内氢气的平均速率:ν(H2)=0.45mol/(L·s),则2s末NH3,的浓度为
| A.0.50mol/L | B.0.60mol/L | C.0.45mol/L | D.0.55mol/L |
一定温度下,在容积固定的密闭容器中发生可逆反应A(g)+2B(g) 2Q(g)。平衡时,各物质的浓度比为c(A):c(B):c(Q)=1:1:2,保持温度不变,以1:1:2的体积比再充入A、B、Q,则下列叙述中正确的是( )
A.刚充入时反应速率υ(正)减小,υ(逆)增大
B.达到新的平衡过程中,体系压强先增大,后逐渐减小
C.达到新的平衡时c(A):c(B):c(Q)仍为1:1:2
D.达到新的平衡时,反 应混合物中A
应混合物中A 、B的体积分数增加
、B的体积分数增加
pH=1的两种一元酸HX和HY的溶液,分别取50mL,加入足量的镁粉,
充分反应,收集的氢气的体积分别为V(HX)和V(HY),若V(HX)>V(HY),下列说法正确的是
| A.HX一定是弱酸 | B.HY一定是强酸 |
| C.HX的酸性强于HY的酸性 | D.反应开始时二者生成H2的速率不相同 |
从下列叙述中,能肯定判断某化学平衡发生移动的是
| A.混合物中各组分的浓度改变 | B.反应物的转化率改变 |
| C.正、逆反应速率改变 | D.混合体系中气体密度发生变化 |
可逆反应N2(g) +3H2(g)2NH3(g) 500℃ 时在容积为5 L的密闭容器中进行,开始时加入1 mol N2和1 mol H2,则达到平衡时,NH3的浓度不可能达到的值是
| A.0.1mol/L | B.0.2mol/L | C.0.15mol/L | D.0.05mol/L |
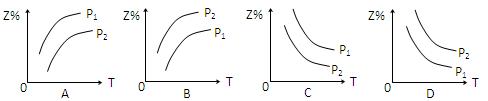
反应:X(g)+3Y(g) 2 Z(g) △H <0,在不同温度、不同压强(P2> P1)下,达平衡时,混合气体中Z的百分含量随温度变化的曲线应为()