.强酸与强碱的稀溶液发生中和反应的热效应为:H+(aq) +OH-(aq)═H2O(l)
△H = -57.3kJ/mol。分别向1L 0.5mol/L的Ba(OH)2的溶液中加入①浓硫酸;② 稀硫酸;③稀硝酸,恰好完全反应的热效应分别为△H1、△H2、△H3,下列关系正确的是
| A.△H1<△H2=△H3 | B.△H1>△H2>△H3 |
| C.△H1>△H2=△H3 | D.△H1=△H2<△H3 |
下列说法不正确的是
| A.静电除尘利用了胶体能发生电泳的性质 |
| B.液氨、液氯、液态氯化氢都是非电解质 |
| C.所有的置换反应都是氧化还原反应 |
| D.使空气中游离态的氮转化为含氮化合物的方法叫做氮的固定 |
将0.5 mol钠与0.5 mol镁分别加入2 mol·L-1、400 mL的硫酸中,所得溶液的质量是
| A.硫酸钠溶液的质量大 | B.同样大 |
| C.硫酸镁溶液的质量大 | D.无法确定 |
2009年2月28日,十一届全国人大常委会第七次会议表决通过的《中华人民共和国食品安全法》旨在维护民众的生命健康安全,新的食品安全法于2009年6月1日起实施。食品检验是保证食品安全的重要措施,下列不属于食品安全检测指标的是
| A.淀粉的含量 |
| B.二氧化硫的含量 |
| C.亚硝酸盐的含量 |
| D.甲醛的含量 |
2008年,我国的航天事业取得了巨大的成就,航天员翟志刚顺利实现了太空行走。下列说法不正确的是
| A.在生活舱中,可用过氧化钠制备氧气 |
| B.金属镁可用作制造飞机、火箭的重要材料 |
| C.在航天试验用的仪器仪表中大量使用了硅等非金属材料 |
| D.返回舱外层的隔热瓦使用的是金属材料 |
4NH3(g)+5O2(g) 4NO(g)+6H2O(g)在10 L密闭容器中进行,10s后,水蒸气的物质的量增加了0.60 mol,则此反应的平均速率
4NO(g)+6H2O(g)在10 L密闭容器中进行,10s后,水蒸气的物质的量增加了0.60 mol,则此反应的平均速率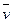 (X)(反应物的消耗速率或产物的生成速率)可表示为( )
(X)(反应物的消耗速率或产物的生成速率)可表示为( )
A.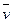 (NH3)=0.0060 mol/(L·s) (NH3)=0.0060 mol/(L·s) |
B.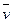 (NO)=0.0040 mol/(L·s) (NO)=0.0040 mol/(L·s) |
C.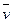 (O2)=0.0060 mol/(L·s) (O2)=0.0060 mol/(L·s) |
D.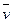 (H2O)=0.036 mol/(L.min) (H2O)=0.036 mol/(L.min) |