已知:25℃、l0lkPa条件下
4Al(s)+3O2(g)=2Al2O3(s) ΔH=-2834.9kJ/mol
4Al(s)+2O3(g)=2Al2O3(s) ΔH=-3119.91kJ/mol: 由此得出的结论正确的是
| A.等质量的O2比O3能量低,由O2变O3为吸热反应 |
| B.等质量的O2比O3能量低,由O2变O3为放热反应 |
| C.O3比O2稳定,由O2变O3为吸热反应 |
| D.O2比O3稳定,由O2变O3为放热反应 |
用惰性电极电解NaCl和CuSO4混合液250 mL,经过一段时间后,两极均得到11.2 L气体(标准状况下),则下列有关描述中,正确的是()
| A.阳极发生的反应只有:4OH--4e-=2H2O+O2↑ |
| B.两极得到的气体均为混合气体 |
| C.若Cu2+起始浓度为1 mol·L-1,则c(Cl-)起始为 2 mol·L-1 |
| D.Cu2+的起始物质的量应大于0.5 mol |
用酸性氢氧燃料电池为电源进行电解的实验装置图如图所示,下列说法中正确的是()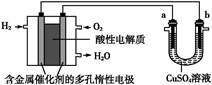
| A.燃料电池工作时,正极反应为:O2+2H2O+4e-=4OH- |
| B.a极是铁,b极是铜时,b极逐渐溶解,a极上有铜析出 |
| C.a极是粗铜,b极是纯铜时,a极逐渐溶解,b极上有铜析出 |
| D.a、b两极均是石墨时,在相同条件下a极产生的气体与电池中消耗的H2体积相等 |
下列叙述中,不正确的是()
| A.原电池是将化学能转化为电能的装置 |
| B.轮船底部镶嵌锌块,锌作负极,以防船体被腐蚀 |
| C.钢铁腐蚀的负极反应:Fe-3e-=Fe3+ |
| D.电镀时,镀层金属作阳极,镀件作阴极 |
如图所示,将铁棒和石墨棒插入1 L 1 mol·L-1食盐水中。下列说法正确的是()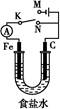
| A.若电键K与N连接,铁被保护不会腐蚀 |
| B.若电键K与N连接,正极反应式是:4OH--4e-=2H2O+O2↑ |
| C.若电键K与M连接,将石墨棒换成铜棒,可实现铁棒上镀铜 |
| D.若电键K与M连接,当两极共产生28 L(标准状况)气体时,生成了1 mol NaOH |
用下图Ⅰ所示装置通电10分钟后,去掉直流电源,连接成图Ⅱ所示装置,可观察到U形管左端铁电极表面析出白色胶状物质,U形管右端液面上升。下列说法正确的是()
| A.同温、同压下,装置Ⅰ中石墨电极上方得到的气体比铁电极上方得到的气体多 |
| B.用装置Ⅱ进行实验时铁电极的电极反应为Fe-2e-+2OH-=Fe(OH)2↓ |
| C.用装置Ⅱ进行实验时石墨电极的电极反应为2H++2e-=H2↑ |
| D.装置Ⅰ通电10分钟后铁电极周围溶液pH降低 |