在某密闭容器内有正反应为放热的可逆反应,其中A、B为气体,C为固体,若反应开始经 s后达平衡。如图:
s后达平衡。如图:
(1)该反应的化学方程式为_________________________
(2)反应物的转化率______________________
(3)要使反应物的转化率增加可能的原因是____________
A.增大了B或C的浓度 B.使用了催化剂
C.缩小体积,使体系压强增大 D.升高了反应温度
(4)该反应达到平衡后,向该容器中再充入0.5mol的He。若恒温恒压,,这时反应速率 _________(填“加快”、“减慢”或“不变”),平衡_____________ (填“向正方向移动”、“向逆方向移动”、“不移动”);若恒温恒容时,这时反应速率_______(填“加快”、“减慢”或“不变”),反应物的转化率___________(填“加快”、“减慢”或“不变”)。
磷在氧气中燃烧,可能生成两种固态氧化物。3.1 g的单质磷(P)在3.2 g氧气中燃烧,至反应物耗尽,并放出X kJ热量。
(1)通过计算确定反应产物的组成(用化学式表示)是,其相应的质量(g)为。
(2)已知单质磷的燃烧热为Y kJ/mol,则1mol P与O2反应生成固态P2O3的反应热ΔH=。
(3)写出1mol P与O2反应生成固态P2O3的热化学方程式:
已知A(g)+B(g)  C(g)+D(g)反应的平衡常数和温度的关系如下:
C(g)+D(g)反应的平衡常数和温度的关系如下:
| |温度/ ℃ |
700 |
900 |
830 |
1000 |
1200 |
| 平衡常数 |
1.7 |
1.1 |
1.0 |
0.6 |
0.4 |
回答下列问题:
(1)该反应的平衡常数表达式K=,△H0(填“<”“ >”“ =”);
(2)830℃时,向一个5 L的密闭容器中充入0.20mol的A和0.80mol的B,如反应初始6s内A的平均反应速率v(A)=0.003 mol·L-1·s-1。,则6s时c(A)= mol·L-1, C的物质的量为mol;若反应经一段时间后,达到平衡时A的转化率为,如果这时向该密闭容器中再充入1 mol氩气,平衡时A的转化率为;
(3)判断该反应是否达到平衡的依据为(填正确选项前的字母):
a.压强不随时间改变 b.气体的密度不随时间改变
c. c(A)不随时问改变 d.单位时间里生成c和D的物质的量相等
(4)1200℃时反应C(g)+D(g) A(g)+B(g)的平衡常数的值为。
A(g)+B(g)的平衡常数的值为。
能源危机当前是一个全球性问题,开源节流是应对能源危机的重要举措。
(1)下列做法有助于能源“开源节流”的是(填字母)。
a. 大力发展农村沼气,将废弃的秸秆转化为清洁高效的能源
b. 大力开采煤、石油和天然气以满足人们日益增长的能源需求
c. 开发太阳能、水能、风能、地热能等新能源、减少使用煤、石油等化石燃料
d. 减少资源消耗,增加资源的重复使用、资源的循环再生
(2)金刚石和石墨均为碳的同素异形体,它们在氧气不足时燃烧生成一氧化碳,在氧气充足时充分燃烧生成二氧化碳,反应中放出的热量如图所示。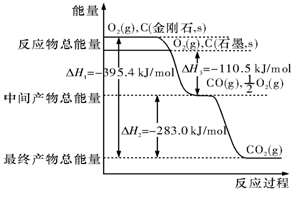
(a)在通常状况下,金刚石和石墨相比较,(填”金刚石”或”石墨”)更稳定,石墨的燃烧热为。
(b)12 g石墨在一定量空气中燃烧,生成气体36 g,该过程放出的热量为。
(3)已知:N2、O2分子中化学键的键能分别是946 kJ ▪mol-1、497 kJ ▪mol-1。
N2 (g)+ O2 (g)="==" 2 NO (g)H="+180.0" kJ ▪mol-1。
NO分子中化学键的键能为kJ ▪mol-1。
(4)综合上述有关信息,请写出用CO除去NO的热化学方程式:。
光气(COCl2)在塑料、制革、制药等工业中有许多用途,工业上采用高温下CO与Cl2在活性炭催化下合成。
COCl2的分解反应为COCl2(g) 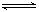 Cl2(g) + CO(g) △H =" +" 108 KJ·mol-1。反应体系达到平衡后,各物质的浓度在不同条件下的变化状况如下图所示(第10 min到14 min的COCl2浓度变化曲线未画出):
Cl2(g) + CO(g) △H =" +" 108 KJ·mol-1。反应体系达到平衡后,各物质的浓度在不同条件下的变化状况如下图所示(第10 min到14 min的COCl2浓度变化曲线未画出):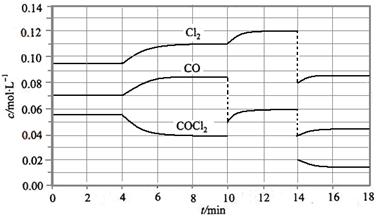
(1) 计算反应在第8 min 时的平衡常数K = ;
(2) 比较第2 min 反应温度T(2)与第8 min反应温度T(8)的高低:T(2)T(8)(填“<”、“>”或“=”);
(3) 若12 min 时反应于温度T(8)下重新达到平衡,则此时c(COCl2) = mol·l-1;
(4) 比较产物CO在2~3 min、5~6 min和12~13 min时平均反应速率[平均反应速率分别以v(2~3)、v(5~6)、v(12~13)表示]的大小 ;
(5)比较反应物COCl2在5~6 min和15~16 min时平均反应速率的大小v(5~6)v(12~13) (填“<”、“>”或“=”),原因是。
用氯气对饮用水消毒已有百年历史。这种消毒方法会使饮用水中的有机物发生氯代反应,生成有机含氯化合物,对人体有害,且氯气本身也是一种有毒气体。世界环保联盟即将全面禁止用氯气对饮用水消毒,建议推广采用广谱性高效消毒剂二氧化氯(ClO2)。目前欧洲一些国家用NaClO3氧化浓盐酸来制取ClO2,同时有Cl2生成,反应的化学方程式为:
___NaClO3+___HCl===___NaCl+___ClO2↑+___Cl2↑+___H2O。
(1)配平上述化学方程式。
(2)此反应中氧化剂是:__________,在反应中盐酸体现的性质是_________和_________;
(3)在标准状况下有4.48L氯气生成时,转移的电子数为_________mol,被氧化的盐酸的物质的量为________mol。
(4)我国研制成功用氯气氧化亚氯酸钠(在氮气保护下)制得ClO2,表示这一反应的化学方程式是2NaClO2+Cl2==2ClO2↑+2A。已知A物质是一种盐,它的化学式为_________。
这一方法的优点是。