水的电离平衡曲线如图所示, 若以A点表示25℃时水的电离达平衡时的离子浓度,B点表示100℃时水的电离达平衡时的离子浓度,则下列说法正确的是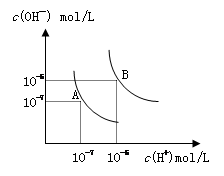
| A.纯水中25℃时的c(H+)比100℃时的c(H+)大 |
| B.100℃时某溶液中由水电离产生的c(H+)=1×10-11mol/L,则该溶液的pH可能是11或3 |
| C.将pH=9的Ba(OH)2溶液与pH=4的稀盐酸混合,并保持100℃的恒温,混合溶液的pH=7,则Ba(OH)2溶液和盐酸的体积比为10: 1 |
| D.25℃时,某Na2SO4溶液中c(SO42-)=5×10-4 mol/L,则溶液中c(Na+):c(OH-)为104:1 |
下列各种混合物中,不能混溶的是
| A.植物油和乙醇 | B.苯和水 | C.酒精和水 | D.汽油和苯 |
下列物质之间的相互关系不正确的是
A.CH3-CH2-NO2和H2N-CH2-COOH互为同分异构体
B.H、D、T互为同位素
C.O2和O3互为同素异形体
D.-OH、-CHO、-H、-COOH都是官能团
下列关于化学与生产、生活的认识不正确的是
| A.CO2、CH4、N2等均是造成温室效应的气体 |
| B.使用清洁能源是防止酸雨发生的重要措施之一 |
| C.节能减排符合低碳经济的要求 |
| D.合理开发利用可燃冰(固态甲烷水合物)有助于缓解能源紧缺 |
能使蛋白质变性的是
①硫酸钾②甲醛③硝酸钾④硝酸汞⑤氯化铵⑥氢氧化钠
| A.②④⑥ | B.①③⑤ | C.①②③ | D.③④⑤ |
某元素原子的质量数为A,它的阴离子Xn-核外有x个电子,w克这种元素的原子核内中子数为
A. |
B.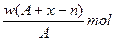 |
C. |
D. |