对于Zn(s)+H2SO4(aq)=ZnSO4(aq)+H2(g) ΔH <0 的化学反应下列叙述不正确的是( )
A.反应过程中能量关系可用下图表示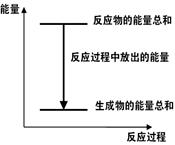 |
| B.ΔH的值与反应方程式的计量系数有关 |
| C.若将该反应设计成原电池则锌为负极 |
| D.若将其设计为原电池,当有32.5g锌溶解时,正极放出气体一定为11.2L |
向四支试管中分别加入少量不同的无色溶液进行如下操作,结论正确的是 ()
| 操作 |
现象 |
结论 |
|
| A |
滴加BaCl2溶液 |
生成白色沉淀 |
原溶液中有SO42- |
| B |
滴加用稀硫酸酸化的硝酸银溶液 |
生成白色沉淀 |
原溶液中有Cl― |
| C |
用洁净铂丝蘸取溶液进行焰色反应 |
火焰呈黄色 |
原溶液中有Na+、无K+ |
| D |
滴加稀NaOH溶液并加热,将湿润红色石蕊试纸置于试管口 |
试纸不变蓝 |
原溶液中无NH4+ |
下列溶液中Cl-的物质的量浓度最大的是
| A.200mL 2.5mol/L MgCl2溶液 | B.1000mL 4mol/L NaCl溶液 |
| C.400mL 5mol/L KClO3溶液 | D.250mL 2mol/L AlCl3溶液 |
化学与生产、生活、社会密切相关。下列有关说法中,错误的是()
| A.今夏,台州地区出现了严重的旱情,缓解旱情的措施之一是用碘化银进行人工增雨 |
| B.新能源汽车的推广与使用有助于减少光化学烟雾的产生 |
| C.利用太阳能、风能和氢能等能源替代化石能源有利于实现“低碳经济” |
| D.华裔科学家高琨在光纤传输信息领域中取得突破性成就,光纤的主要成分是高纯度的单质硅 |
下列物质的分类正确的是( )
| 单质 |
酸性氧化物 |
碱性氧化物 |
酸 |
碱 |
盐 |
|
| A |
H2 |
干冰 |
CuO |
H2SO4 |
纯碱 |
熟石灰 |
| B |
碘酒 |
CO |
Na2O |
HCl |
NH3·H2O |
NaCl |
| C |
液氯 |
SO2 |
Mn2O7 |
CH3COOH |
CH3CH2OH |
胆矾 |
| D |
HD |
P2O5 |
生石灰 |
HNO3 |
KOH |
CaCO3 |
“封管实验”具有简易、方便、节约、绿色等优点,观察下面四个“封管实验”(夹持装置未画出),判断下列说法正确的是()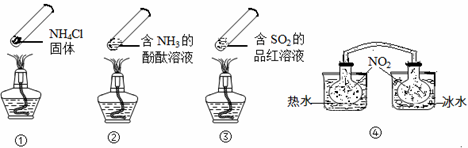
| A.加热时,①上部汇集了固体NH4Cl,说明NH4Cl的热稳定性比较好 |
| B.加热时,②、③溶液均变红,冷却后又都变为无色 |
| C.④中,浸泡在热水中的容器内气体颜色变深,浸泡在冰水中的容器内气体颜色变浅 |
| D.四个“封管实验”中所发生的化学反应都是可逆反应 |