熔融盐燃料电池具有高的发电效率,因而受到重视。用Li2CO3和Na2CO3的熔融盐混合物作电解质,一极通CO气体,另一极通O2和CO2混合气体,可制得在650℃下工作的燃料电池。已知该电池总反应为:2CO+O2=2CO2。则下列说法中正确的是( )
| A.通CO的一极是电池的正极 |
| B.该电池工作过程中需不断补充CO和O2,CO2可循环利用 |
| C.负极反应式为:O2+2CO2+4e-→2CO32- |
| D.正极反应式为:2CO+2CO32-→4CO2+4e- |
关于下列图示的说法中正确的是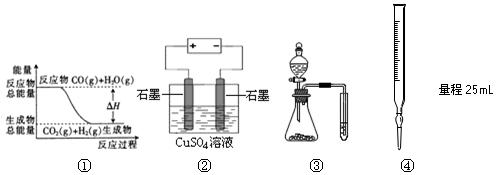
A.图①表示可逆反应“CO(g) + H2O(g) CO2(g)+H2(g)”中的ΔH大于0 CO2(g)+H2(g)”中的ΔH大于0 |
| B.图②为电解硫酸铜溶液的装置,一定时间内,两电极产生单质的物质的量之比一定为1︰1 |
| C.图③实验装置可完成比较乙酸、碳酸、苯酚酸性强弱的实验 |
| D.图④量取0.10 mol•L-1KMnO420.00mL |
某无色溶液中可能含有I-、NH4+、Cu2+、SO32 -(还原性SO32 -大于I-),
向该溶液中加入少量溴水,溶液仍呈无色,则下列关于溶液组成的判断正确的是
①肯定不含I-;②肯定不含Cu2+;③肯定含有SO32 -;④可能含有I-。
| A.①③ | B.①②③ | C.①② | D.②③④ |
已知H2C2O4是二元弱酸,酸式盐NaHC2O4的溶液呈酸性。30℃时,浓度均为0.1mol•L-1 NaHC2O4溶液和Na2C2O4溶液中均存在的关系是
| A.c(H+)•c(OH-) =1×10-14 |
| B.c(H+) + c(H2C2O4) =c(C2O42-)+ c(OH-) |
| C.c(Na+)+ c(H+)= c(OH-)+ c(HC2O4--)+ 2c(C2O42-) |
| D.c(OH-) = c(H+) +c(HC2O4-)+ 2c(H2C2O4) |
不能实现下列物质间直接转化的元素是
| A.硅 | B.硫 | C.碳 | D.钠 |
H3AsO3与SnCl2在浓盐酸中可发生以下反应:
3SnCl2+12Cl-+2H3AsO3+6H+=2As+3M+6H2O关于该反应的说法中正确的组合是
①氧化剂是H3AsO3;②还原性:Cl->As;③每生成1 mol As,反应中转移电子的物质的量为2 mol;④ M为SnCl62-;⑤ M是氧化产物。
| A.①④⑤ | B.①②⑤ | C.①③④ | D.①③⑤ |