某工业废水含有下列离子中的5种,K+、Cu2+、Al3+、Fe2+、Cl-、CO32-、NO3-、SO42-,且各种离子的物质的量浓度相等。甲同学欲探究废水的组成,进行了如下实验:
①用铂丝蘸取少量溶液,在火焰上灼烧,透过蓝色钴玻璃观察无紫色火焰。
②另取溶液加入足量稀盐酸,有无色气体生成,该无色气体遇空气变成红棕色,此时溶液依然澄清,且溶液中阴离子种类不变。
③另取溶液加入BaCl2溶液,有白色沉淀生成。
根据上述实验,以下推测正确的是:( )
| A.溶液中难以确定Al3+的存在与否 |
| B.原溶液中所含的离子为:Cu2+、Fe2+、Cl-、NO3-、SO42- |
| C.步骤②中可以确定Fe2+、NO3-的存在,不能确定其它离子的存在 |
| D.步骤③中的白色沉淀为2种钡盐 |
1.92g铜投人一定盆的浓HNO3中、铜完全溶解,生成的气体颜色越来越浅,共收集到标准状况下672mL气体。将盛有此气休的容器倒扣在水中.通入标准状况下一定体积的氧气恰好使气体完全被水吸收生成硝酸。则通入O2的体积是
| A.504mL | B.336mL | C.224mL | D.168mL |
下列关干氧化物的各项叙述正确的是
①酸性氧化物不一定是非金属氧化物②非金属氧化物肯定是酸性氧化物
③碱性氧化物肯定是金属氧化物④金属氧化物肯定是喊性氧化物
⑤酸性氧化物均可与水反应生成相应的酸
⑥与水反应生成酸的氧化物不一定是酸性氧化物,与水反应生成碱的氧化物不一定是碱住氧化物
⑦不能跟酸反应的氧化物一定能跟碱反应
| A.①③⑥ | B.①②⑤⑦ | C.③④⑤ | D.①②⑤ |
下列离子方程式正确且与对应实验相符合的是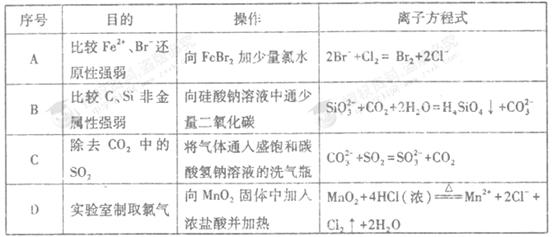
化学方程式可简明地体现元素及其化合物的性质。已知:
氧化还原反应:2FeCl3+2HI=2FeCl2+I2+2HCl;2Co(OH)3+6HCl=2CoCl2+Cl2↑+6H2O;
2Fe(OH)2+I2+2KOH=2Fe(OH)3+2KI;3I2+6KOH=5KI+KIO3+3H2O
复分解反应:2HSCN+K2CO3=2KSCN+CO2↑+H2O; KCN+CO2+H2O=HCN+KHCO3
热分解反应:4NaClO3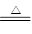 NaCl+NaClO4;NaClO4
NaCl+NaClO4;NaClO4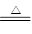 NaCl+2O2↑
NaCl+2O2↑
下列说法不正确是:
| A.酸性(水溶液): HSCN>H2CO3>HCN |
| B.还原性(碱性溶液): Fe(OH)2>I2>KIO3 |
| C.热稳定性: NaCl>NaClO4>NaClO |
| D.氧化性(酸性溶液): I2>FeCl3>Co(OH)3 |
工业上用的铝上矿(主要成分是氧化铝.含氧化铁杂质)为原料冶炼铝的工艺流程如下:
下列叙述正确的是
| A.反应①中试剂X是氢氧化钠溶液 |
| B.试剂Y是HCI,它与AlO2-反应生成氢氧化铝 |
| C.图中所示转化反应中包含2个氧化还原反应 |
| D.将X与Y试剂进行对换,最终可以达到相同结果 |