已知氢气和碳燃烧的热化学方程式为:
①2H2(g)+O2(g)=2H2O(l) △H1=-akJ·mol-1
②H2(g)+1/2O2(g)=H2O(g) △H2=-bkJ·mol-1
③C(s)+1/2O2(g)=CO(g) △H3=-ckJ·mol-1
④C(s)+O2(g)=CO2(g) △H4=-dkJ·mol-1
下列说法错误的是
| A.氢气的燃烧热为△H=-akJ·mol-1 | B.c<d |
| C.一氧化碳的燃烧热为△H=-(d-c)kJ·mol-1 | D.0.5a>b |
下列有关化学用语使用正确的是:
A.CH4分子的比例模型: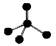 |
B.NH4Cl的电子式: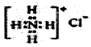 |
C.硫离子的离子结构示意图: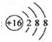 |
D.聚丙烯的结构简式为: |
以节能减排为基础的低碳经济是保持社会可持续发展的战略举措。下列做法违背发展低碳经济的是
| A.尽量购买本地的、当季的食物 | B.发展氢能和太阳能 |
| C.提高原子利用率,发展绿色化学 | D.尽量用纯液态有机物代替水作溶剂 |
将0.6 mol A和0.5 mol B充入0.4L密闭容器中发生2A(g)+B(g) 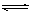 mD(g)+E(g),经过5min后达到化学平衡,此时测得D为0.2 mol。又知5min内用E表示的平均反应速
mD(g)+E(g),经过5min后达到化学平衡,此时测得D为0.2 mol。又知5min内用E表示的平均反应速
率为0.1 mol·L-1·min-1,下列结论正确的是()
A.A、B的转化率均为20%
B.m值为1
C.5min内用A表示的平均反应速率为0.1 mol·L-1·min-1
D.平衡时混合物总物质的量为1 mol
下列叙述正确的是()
| A.PCl3和BCl3分子中所有原子的最外层都达到8电子稳定结构 |
| B.H2S和CS2分子都是含极性键的极性分子 |
| C.(CN)2为直线形分子,含有3个σ键和4个π键 |
| D.NF3与NH3的空间构型都是三角锥形,都易与Cu2+形成配离子 |
将纯锌片和纯铜片插入同浓度同体积的稀硫酸中一段时间,以下叙述正确的是()
| A.两烧杯中铜片表面均无气泡产生 |
| B.甲中铜片是正极,乙中铜片是负极 |
| C.两烧杯的溶液中H+ 浓度均减小 |
| D.乙装置中化学能转化为电能 |