为比较Fe3+和Cu2+对H2O2分解的催化效果,某化学研究小组的同学分别设计了如图甲、乙所示的实验。请回答相关问题: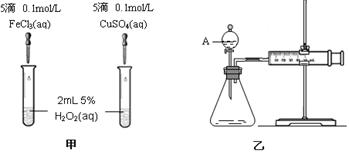
(1)定性分析:如图甲可通过观察 ,定性比较得出结论。有同学提出将FeCl3改为Fe2(SO4)3更为合理,其理由是 。
(2)定量分析:如图乙所示,实验时均以生成40mL气体为准,其它可能影响实验的因素均已忽略。图中仪器A的名称为 ,检查该装置气密性的方法是 ,
实验中需要测量的数据是 。
(3)加入0.10 mol MnO2粉末于50 mL H2O2溶液中,在标准状况下放出气体的体积和时间的关系如图所示。实验过程中速率变化的趋势是 ,可能原因是 。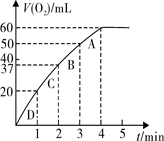
计算H2O2的初始物质的量浓度为 mol/L(请保留两位有效数字)。
超音速飞机在平流层飞行时,尾气中的NO会破坏臭氧层。科学家正在研究利用催化技术将尾气中的NO和CO转变成CO2和N2,化学方程式如下:
2NO+2CO  2CO2+N2
2CO2+N2
为了测定在某种催化剂作用下的反应速率,在某温度下用气体传感器测得不同时间的NO和CO浓度如下表:
时间/s |
0 |
1 |
2 |
3 |
4 |
5 |
c(NO)/ mol·L-1 |
1.00×10-3 |
4.50×10-4 |
2.50×10-4 |
1.50×10-4 |
1.00×10-4 |
1.00×10-4 |
c(CO)/ mol·L-1 |
3.60×10-3 |
3.05×10-3 |
2.85×10-3 |
2.75×10-3 |
2.70×10-3 |
2.70×10-3 |
请回答下列问题(均不考虑温度变化对催化剂催化效率的影响):
(1)写出该反应的平衡常数表达式K=。
(2)前2s内的平均反应速率v(N2)=_____________。
(3)在上述条件下反应能够自发进行,则反应的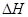 0(填写“>”、“<”、“=”)。
0(填写“>”、“<”、“=”)。
(4)假设在密闭容器中发生上述反应,达到平衡时下列措施能提高NO转化率的是。
A.选用更有效的催化剂 B.升高反应体系的温度
C.降低反应体系的温度 D.缩小容器的体积
(5)研究表明:在使用等质量催化剂时,增大催化剂比表面积可提高化学反应速率。为了分别验证温度、催化剂比表面积对化学反应速率的影响规律,某同学设计了三组实验,部分实验条件已经填在下面实验设计表中,请在表格中填入剩余的实验条
件数据。
| 实验编号 |
T/℃ |
NO初始浓度 mol·L-1 |
CO初始浓度 mol·L-1 |
催化剂的比表面积 ㎡·g-1 |
| Ⅰ |
280 |
1.2×10-3 |
5.8×10-3 |
82 |
| Ⅱ |
5.8×10-3 |
124 |
||
| Ⅲ |
350 |
1.2×10-3 |
某研究性学习小组,为了探究电极与原电池的电解质之间关系,设计了下列实验方案:用铝片、铜片、镁片作电极,分别与下列溶液构成原电池,并接电流表。
(1)若电解质溶液为0.5mol/L硫酸,电极为铜片和铝片,则电流计指针偏向(填“铝”或“铜”)。
(2)若用浓硝酸作电解质溶液,电极为铜片和铝片,则电流计指针偏向(填“铝”或“铜”),铝做(填“正”或“负”),正极上电极反应式为:
(3)若电解质溶液为0.5mol/L氢氧化钠溶液,电极为镁片和铝片,则正极发生的电极反应为。
通过上述实验探究,你受到的启示是
(16分) 红磷P(s)和Cl2(g)发生反应生成PCl3(g)和PCl5(g)。反应过程和能量关系如图所示(图中的△H表示生成1mol产物的数据)。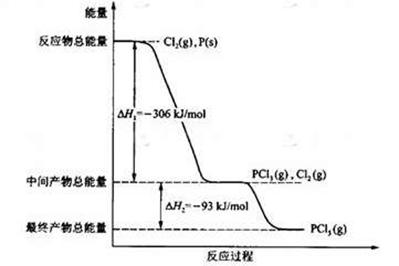
根据上图回答下列问题:(1)P和Cl2反应生成PCl3的热化学方程式是
;
(2)PCl5分解成PCl3和Cl2的热化学方程式是
;
上述分解反应是一个可逆反应。温度T1时,在密闭容器中加入0.80mol PCl5,反应达平衡时PCl5还剩0.60 mol,其分解率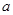 1等于;若反应温度由T1升高到T2,平衡时PCl5的分解率为
1等于;若反应温度由T1升高到T2,平衡时PCl5的分解率为 2,
2,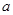 2
2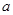 1(填“大于”、“小于”或“等于”);
1(填“大于”、“小于”或“等于”);
(3)工业上制备PCl5通常分两步进行,现将P和Cl2反应生成中间产物PCl3,然后降温,再和Cl2反应生成PCl5。原因是
;
(4)P和Cl2分两步反应生成1 mol PCl5的△H 3=,P和Cl2一步反应生成1 mol PCl5的△H 4△H 3(填“大于”、“小于”或“等于”)。
(5)PCl5与足量水充分反应,最终生成两种酸,其化学方程式是
。
(6分) 某研究小组拟用定量的方法测量Al和Fe分别与酸反应的快慢,设计了如下图1所示的装置。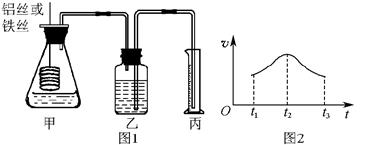
(1)检查图1所示装置气密性的方法是____________________。
(2)若要比较产生气体的快慢,可以测量相同时间段内产生气体的体积,也可以测量__________________________。
(3)实验测得铝丝产生气体的速率(v)与时间(t)的关系如图2所示,则t1~t2时间段内反应速率逐渐加快的主要原因是__________________________________。
【化学——物质结构与性质】
氮族元素包括N、P、As、Sb和Bi五种元素。
(1)下列关于氮族元素的说法正确的是。
| A.N2可用于填充霓虹灯。其发光原理是电子从能量较低的轨道跃迁到能量较高的轨道,以光的形式释放能量 |
| B.P、Na、S三种元素的第一电离能由大到小的顺序是:P>S>Na |
| C.基态As原子中,电子占据的最高能级为4d |
| D.Bi原子中最外层有5个能量相同的电子 |
(2)NH3在水中的溶解度比PH3大得多,其原因是。向硫酸铜溶液中加入过量氨水,然后加入适量乙醇,溶液中析出深蓝色的[Cu(NH3)4]SO4晶体。该晶体中含有的化学键除普通的共价键外,还有和。
(3)PCl3分子中,Cl-P-Cl键的键角____109o28’(填“>”“<”或“=”)。
(4)白磷(P4)是磷的一种单质,它属于分子晶体,其晶胞结构如图。己知该晶体的密度为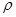 g·cm-3,晶胞的边长为acm,则阿伏加德罗常数为__mol-l(用含ρ、a的式子表示)。
g·cm-3,晶胞的边长为acm,则阿伏加德罗常数为__mol-l(用含ρ、a的式子表示)。