阿斯匹林(aspirin)的有效成分是乙酰水杨酸,它是19世纪末合成成功的,作为一个有效的解热止痛、治疗感冒的药物,至今仍广泛使用,有关报道表明,人们正在发现它的某些新功能。阿斯匹林是由水杨酸(邻羟基苯甲酸)与乙酸酐进行酯化反应而得的。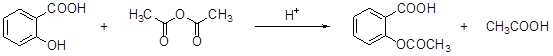
水杨酸 乙酸酐 乙酰水杨酸
(1)乙酰水杨酸的含氧官能团分别是 和酯基。
(2)乙酰水杨酸不应具有的性质( )
| A.与NaOH溶液反应 | B.与金属钠反应 |
| C.与乙酸发生酯化反应 | D.与乙醇发生酯化反应 |
(3)写出乙酰水杨酸与稀酸溶液共热的化学方程式:
(4)为测定阿斯匹林中有效成分的含量,称取样品0.250 0 g ,准确加入浓度为0.1015 mol·L- NaOH溶液50.00 mL,煮沸60min。冷却后用浓度为0.1015 mol·L-1的HC1溶液返滴过量的NaOH,消耗HC1溶液记录如下:
| 次数 数据 |
1 |
2 |
3 |
| 初始读数 |
2.00 |
12.50 |
5.20 |
| 最后读数 |
27.10 |
37.40 |
33.20 |
则该产品中乙酰水杨酸的含量为(乙酰水杨酸的摩尔质量是180.16 g·mol-1) 。(只要求列式表示,不计算出最后结果) 。
现有九种物质(1)铝线(2)石墨(3)氯气(4)硫酸镁晶体(5)无水乙酸(6)金刚石(7)石灰水(8)乙醇(9)熔融的硝酸钾
其中能导电的是 ;
属于电解质的是 ;
既不是电解质也不是非电解质的是 .
乙酸的电离方程式是
乙酸钠水解的离子方程式是
将25℃、101KPa条件下的氯化氢(HCl)气体49.6L,通入127mL水中(已知水的密度为:1.00g/mL),得到密度为1.19g/mL的盐酸(即氯化氢的水溶液)。(注:25℃、101KPa条件下气体摩尔体积为24.8L/mol。)
(1)此盐酸的溶质的质量分数为 ;
(2)此盐酸的溶质的物质的量浓度为 mol/L;
(3)取出20.0 mL该溶液,配成浓度为1.00 mol/L的稀溶液,则稀释后溶液的体积是 mL;
(4)0.100 mol/L的稀盐酸500mL中含有的氯离子的数目为 。
(1)写出下列反应的化学方程式,用双线桥标明电子转移的方向和数目,并注明“被氧化”、“被还原”。 KClO3和MnO2在共热条件下反应: _______________________________。
(2)写出下列反应的离子方程式,并用单线桥标明电子转移的方向和数目。
实验室制Cl2的反应为MnO2+4HCl(浓)  MnCl2+Cl2↑+2H2O:_____________________________。
MnCl2+Cl2↑+2H2O:_____________________________。
有五瓶损坏标签的试剂,分别盛有AgNO3溶液、稀硝酸、盐酸、BaCl2溶液、K2CO3溶液,为了确定各瓶中是什么试剂,将它们任意编号为A B C D E,用小试管各盛少量,多次进行两两混合反应,反应现象为:A与B、A与E产生沉淀,B与D、B与E产生沉淀,C与E、D与E产生气体,而C与D无反应现象。由此,可判定各试剂瓶中所盛试剂为:
A________,B________,C________,D________,E________。
另外,请写出下列反应的离子方程式:
(1)A与E:____________________________________。
(2)B与E:____________________________________。
(3)C与E:____________________________________。
根据反应3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O,回答下列问题:
(1)还原剂是________,还原产物是________,氧化剂是________,氧化产物是________。
(2)还原剂与还原产物的物质的量之比是________。
(3)当有8 mol HNO3参加反应时,被氧化的物质的质量为________g,反应中转移的电子的物质的量为________ mol。