电解原理在化学工业中有广泛应用。下图表示一个电解池,装有电解液a;X、Y是两块电极极板,通过导线与直流电源相连。下列说法不正确的是 ( )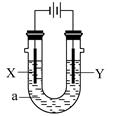
| A.若电镀铜,则Y为铜电极,电解液a可以是硫酸铜或氯化铜溶液 |
| B.若X为铁电极、Y为石墨电极,电解饱和氯化钠溶液一段时间,在两极分别滴加酚酞,X极变红色 |
| C.若用惰性电极电解一定浓度的硫酸铜溶液,通电一段时间后,加入0.1mol的氢氧化铜溶解,刚好恢复到通电前的浓度,则电解过程中转移的电子为0.2mol |
| D.若X、Y为铂电极,a溶液为250mL CuSO4和KNO3的混合液,经过一段时间后,两极均得到标准状况下5.6L气体,则原混合液中CuSO4的物质的量浓度为1mol·L-1 |
下列实验装置图所示的实验操作,不能达到相应的实验目的的是
下列说法正确的是
| A.标准状况下,22.4LCO2与22.4LH2SO4含有相同的分子数。 |
| B.标准状况下,1mol氧气和氮气的混和气体(任意比)的体积约为22.4L |
| C.常温下32gO2含分子数小于NA个。 |
| D.22.4L气体所含的分子数一定大于11.2L气体所含的分子数。 |
下列状态的物质,既能导电又属于电解质的是
| A.KNO3晶体 | B.盐酸 | C.液态氯化氢 | D.熔融的KOH |
下列叙述与胶体的性质无关的是
| A.同一支钢笔使用不同品牌墨水时,容易发生堵塞现象 |
| B.当日光从窗隙射入暗室时,可观察到一束光线 |
| C.向氢氧化铁与水形成的某分散系中插入正.负电极,通直流电一段时间后,一极附近颜色变深 |
| D.向氯化铁溶液中加入氢氧化钠溶液,产生红褐色沉淀 |
下列化学药品与其危险化学品图形标志不一致的一组是
| A.烧碱——1 | B.甲烷——2 | C.酒精——3 | D.白磷——4 |