下面是有名的Diels—Alder反应的一个实例: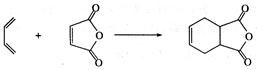
请认真分析上述变化,回答下列问题:
以某链烃A为起始原料合成化合物G的路径如下(图中Mr表示相对分子质量):
(1)指出反应类型:B→C________,F→G_________。
(2)写出下列物质的结构简式:A______________,F_____________。
(3)写出下列反应的化学方程式:B→C________,D→E___________。
(4)C→D的转化不能一步实现,请设计C→D的合成路线:_____________。
现有部分短周期元素的性质或原子结构如下表:
| 元素编号 |
元素性质或原子结构 |
| X |
X+具有与Ne原子相同的电子层结构 |
| Y |
最外层电子数是次外层的一半,其最高正价与最低负价的绝对值相等 |
| Z |
常温下单质为双原子分子,其氢化物水溶液呈碱性 |
| T |
元素单质的颜色是黄绿色的气体 |
(1) Y在周期表中的位置是,Z的原子结构示意图是。
(2) X元素与T元素形成化合物的电子式是。
(3) X的最高价氧化物对应水化物的化学式是,化学键类型有。
(4) Y和Z的最高价氧化物对应的水化物中酸性较强的是(填化学式)
写出可以验证该结论的一个简单易行的实验方案
。
请根据实验目的填写简要的实验方法(包括使用的仪器、操作及现象)。
| 序号 |
实验目的 |
实验方法 |
| ① |
检验混合气体N2和NH3中有NH3 |
|
| ② |
除去NaCl和NH4Cl固体混合物中的杂质NH4Cl |
|
| ③ |
观察铜与浓硫酸在试管中共热后产物溶液的颜色 |
A、B、C、D是中学化学中常见的四种化合物,它们分别由两种元素组成.甲、乙、丙是单质,甲、丙、A、C、D常温下均为气体,B为液体.这些单质和化合物之间存在如下关系:
(1)写出下列物质的分子式:A_______ 甲_______、丙_______.
(2)写出单质甲跟化合物C反应,生成SO2和化合物B的化学方程式_____________.
(3)标准状况下将28L化合物A与足量的过氧化钠充分反应转移电子的数目为
(4)在密闭容器中,化合物B跟化合物D在高温下生成化合物A和单质丙的反应是可逆反应,其化学方程式为__________。
(5)化合物C的稳定性比化合物B(填强或弱)。
食盐中含有一定量的镁、铁等杂质元素,某学习小组对加碘盐进行如下实验(已知:氧化性:IO-3>Fe3+>I2);取一定量某加碘盐(可能含有KIO3、KI、Mg2+、Fe3+),用适量蒸馏水溶液解,并加稀盐酸酸化,将所得溶液分为3份。第一份试液中滴加KSCN溶液后显红色;第二份试液中加足量KI固体,溶液显淡黄色,用CCl4萃取,下层溶液显紫红色;第三份试液中加入适量KIO3固体后,滴加淀粉试剂,溶液不变化。
(1)由此可知,该加碘盐中的含碘物质是(填化学式);
(2)第一份试液加KSCN溶液显红色,写出该反应的离子方程式;
(3)第二份试液加CCl4萃取后下层溶液中显紫红色的物质是(填化学式):
(4)第二份试液中加入足量KI固体,先后发生反应的离子方程式为。
短周期元素Q、R、T、W在元素周期表中的位置如图所示,其中T所处的周期序数与主族序数相等,请回答下列问题:
(1)T在周期表中的位置 __________,第六周期与R同主族元素的原子序数为,该元素为元素(填“金属”或“非金属”)
(2)元素的非金属性(原子得电子的能力):Q________T(填“强于”或“弱于”)。
(3)W的单质与其最高价氧化物的水化物浓溶液共热能发生反应,生成两种物质,其中一种是气体,反应的化学方程式为______________________________________________。
(4)R有多种氧化物,其中甲的相对分子质量最小。在一定条件下,2 L的甲气体与0.5 L的氧气相混合,若该混合气体被足量的NaOH溶液完全吸收后没有气体残留,所生成的 R的含氧酸盐只有一种,则该含氧酸盐的化学式是____________。