在不同温度下,水溶液中c(H+)与c(OH-)有如图所示关系。下列条件下关于离子存在的说法中正确的是( )
| A.c点对应的溶液中大量存在:Na+、Ba2+、Cl-、Fe2+ |
B.b点对应的溶液中大量存在: 、K+、Cl-、 、K+、Cl-、 |
| C.d点对应的溶液中大量存在:Al3+、K+、ClO-、Cl- |
D.a点对应的溶液中大量存在: 、Na+、Cl-、 、Na+、Cl-、 |
已知NaHSO4在水中的电离方程式为:NaHSO 4==Na++H++SO
4==Na++H++SO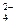 。某温度下,向pH=6的蒸馏水中加入NaHSO4晶体,保持温度不变,测得溶液的pH为2。下列对该溶液的叙述中,不正确的是
。某温度下,向pH=6的蒸馏水中加入NaHSO4晶体,保持温度不变,测得溶液的pH为2。下列对该溶液的叙述中,不正确的是
| A.该温度高于25℃ |
| B.由水电离出来的H+的浓度是1.0×10-12mol·L-1 |
| C.加入NaHSO4晶体抑制了水的电离 |
| D.该温度下加入等体积pH为12的NaOH溶液可使该溶液性呈碱性 |
通过分别加入AgNO3、Ba(NO3)2、Mg(NO3)2三种试剂,使某溶液中的Cl-、OH-、CO32-先后沉淀出来,逐一加以分离,则加入三种试剂的顺序是
| A.AgNO3、Ba(NO3)2、Mg(NO3)2 | B.Mg(NO3)2、Ba(NO3)2、AgNO3 |
| C.Ba(NO3)2、AgNO3、Mg(NO3)2 | D.Ba(NO3)2、Mg(NO3)2、AgNO3 |
下列表示水解的离子方程式正确的是
A.CH3COO— + H2O CH3COOH + OH— CH3COOH + OH— |
B.NH4+ + H2O N N H4OH + H+ H4OH + H+ |
C.S2-+2H2O H2S+2 OH— H2S+2 OH— |
D.HCO3-+H2O  H3O++CO32- H3O++CO32- |
下列生产、生活等实际应用,不能用勒夏特列原理解释的是
A.溴水中有下列平衡Br2+H2O HBr + HBrO,当加入AgNO3溶液后溶液颜色变浅 HBr + HBrO,当加入AgNO3溶液后溶液颜色变浅 |
| B.合成氨工业中使用铁触媒做催化剂 |
| C.合成NH3反应,为提高NH3的产率,理论上应采取低温度的措施 |
D.对2HI(g) H2(g)+I2(g),保持容器体积不变,通入氢气可使平衡体系颜色变浅 H2(g)+I2(g),保持容器体积不变,通入氢气可使平衡体系颜色变浅 |
将0.5mol的下列物质溶于500ml水中,,含阴离子数目最多的是
| A.CaCO3 | B.CH3COONa | C.NH3 | D.Na2SO3 |