某由离子化合物组成的混合物只可能含有以下离子中的若干种:K+、NH4+、Mg2+、Ba2+、Cl-、CO32-、SO42-。为确定其组成,准确称取14.82g混合物溶于水得300 mL澄清溶液,分成三等份分别进行如下实验:
(1)第一份加入AgNO3溶液有沉淀产生
(2)第二份加足量NaOH溶液并加热,经碱石灰干燥后收集到标况下气体1.12L
(3)第三份加足量BaCl2溶液,沉淀经洗涤、干燥后称重为6.27g,再向沉淀中加足量盐酸,经过滤、洗涤、干燥后称重为2.33 g
根据上述实验,以下推测不正确的是
| A.溶液中c(SO42-)为0.1mol/L、c(CO32-) 为0.2mol/L |
| B.该混合物中不含Ba2+、Mg2+ |
| C.一定存在NH4+、 K+,无法确定Cl-是否存在 |
| D.实验(3)沉淀中加盐酸后,若只过滤、不洗涤,会对除NH4+外的其他离子含量的测定造成影响 |
对于常温pH=1的硝酸溶液,下列叙述正确的是:
| A.向该溶液加入等体积,0.1mol/L的Ba(OH)2溶液恰好完全中和 |
| B.该溶液硝酸电离的c (H+) 与水电离的c (H+)之比值为10-12 |
| C.该溶液1mL稀释至100mL后,pH为3 |
| D.该溶液中存在电离平衡,电离是吸热反应 |
一定条件下,可逆反应N2(g)+3H2(g)  2NH3(g) ΔH<0,化学反应速率与反应时间的关系如右图所示。10秒内,c(H2)下降了0.75mol/L,下列说法不正确的是:
2NH3(g) ΔH<0,化学反应速率与反应时间的关系如右图所示。10秒内,c(H2)下降了0.75mol/L,下列说法不正确的是: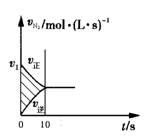
| A.图中v1大于0.05 mol/(L·s) |
| B.氢气的起始瞬时速率为0.075mol/(L·s) |
| C.10秒内氨气的平均速率为0.05mol/(L·s) |
| D.其他条件不变,升高温度,v1增大,阴影面积减少 |
把a L含(NH4)2SO4和NH4NO3的混合液分为两等份:一份加入bmol 烧碱并加热,恰好把NH3全部赶出,另一份需含c molBaCl2溶液,使沉淀反应刚好完全,则NO3ˉ的浓度是
A. mol/L mol/L |
B.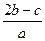 mol/L mol/L |
C. mol/L mol/L |
D. mol/L mol/L |
2007年10月,一台湾女孩因食用河虾后服用大剂量的维生素C而中毒。菜谱中记载:河虾不宜与西红柿同食。主要原因是河虾中含有+5价砷,西红柿中含有比较多的维生素C,两者同食时会生成有毒的+3价砷。下列说法正确的是
| A.在该反应中维生素C作催化剂 |
| B.因为河虾中含有砷元素,所以不能食用 |
| C.砒霜是砷的氧化物,由上述信息可推知砒霜中含有的砷是+3价 |
| D.上述反应中维生素C作氧化剂 |
用Na2SO3还原MnO4-,如果还原含有2.4×10-3molMnO4-的溶液时,消耗30mL0.2mol/LNa2SO3溶液,则Mn元素在还原产物中的化合价是
| A.+1 | B.+2 | C.+4 | D.+5 |