分类法在化学研究中起到了非常重要的作用。下列对物质的分类正确的组合是
①酸性氧化物:CO2、SO2、SiO2 ②混合物:漂白粉、氨水、铝热剂 ③电解质:氯气、硫酸钡、酒精 ④同位素: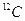 、
、 与
与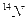 ⑤同素异形体:C60、金刚石、石墨 ⑥胶体:豆浆、硅酸、食盐水
⑤同素异形体:C60、金刚石、石墨 ⑥胶体:豆浆、硅酸、食盐水
| A.只有①②④ | B.只有②③④ | C.只有①②⑤ | D.只有②⑤⑥ |
相同温度下,容积均恒为2L的甲、乙、丙3个密闭容器中发生反应:2SO2(g)+O2(g) 2SO3(g)△H=-197kJ·mol-l。实验测得起始、平衡时的有关数据如下表:
2SO3(g)△H=-197kJ·mol-l。实验测得起始、平衡时的有关数据如下表:
下列叙述正确的是
| A.Q1>Q3>Q2 =78.8kJ |
| B.三个容器中反应的平衡常数均为K=2 |
| C.甲中反应达到平衡时,若升高温度,则SO2的转化率将大于50% |
| D.若乙容器中的反应经tmin达到平衡,则0~tmin内,v(O2)=1/(5t) mol/(L·min) |
在相同容积的4个密闭容器中进行同一种可逆反应,2A(g)+B(g)  3C(g)+2D(g),起始时4个容器所盛A、B的量如下表所示: 各容器所盛物质的量
3C(g)+2D(g),起始时4个容器所盛A、B的量如下表所示: 各容器所盛物质的量
| 容器 |
甲 |
乙 |
丙 |
丁 |
| A |
2mol |
1mol |
2mol |
1mol |
| B |
1mol |
1mol |
2mol |
2mol |
在相同温度下,建立平衡时,4个容器中A或B的转化率的大小关系是
A.A的转化率为:甲<丙<乙<丁
B.A的转化率为:甲<乙<丙<丁
C.B的转化率为:甲>丙>乙>丁
D.B的转化率为:丁>丙>乙>甲
将等物质的量的A、B混合于2 L的密闭容器中,发生如下反应3A(g)+B(g)  xC(g)+2D(g),经5 min后测得D的浓度为0.5 mol·L-1,c(A)∶c(B)=3∶5,用C的浓度变化表示的平均反应速率为0.1 mol·L-1·min-1。下列有关结论正确的是
xC(g)+2D(g),经5 min后测得D的浓度为0.5 mol·L-1,c(A)∶c(B)=3∶5,用C的浓度变化表示的平均反应速率为0.1 mol·L-1·min-1。下列有关结论正确的是
A.x的值为1
B.用B的浓度变化表示的平均反应速率为0.2 mol·L-1·min-1
C.反应开始前A的物质的量为3 mol
D.5 min时A的浓度为0.2 mol·L-1
反应速率v和反应物浓度的关系是用实验的方法测定的,化学反应H2+Cl2===2HCl的反应速率v可表示为v=k[c(H2)]m[c(Cl2)]n,式中k为常数,m、n值可用表中数据确定。
| c(H2)/mol·L-1 |
c(Cl2)/mol·L-1 |
v/[mol·L-1·s-1] |
| 1.0 |
1.0 |
1.0 k |
| 2.0 |
1.0 |
2.0 k |
| 2.0 |
4.0 |
4.0 k |
由此可推得,m、n值正确的是
A.m=1,n=1 B.m=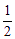 ,n=
,n=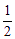 C.m=
C.m=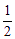 ,n=1 D.m=1,n=
,n=1 D.m=1,n=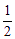
如图所示,甲池的总反应式为2CH3OH+3O2+4KOH=2K2CO3+6H2O。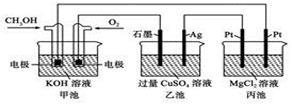
下列说法正确的是
| A.甲池是电能转化为化学能的装置,乙、丙池是化学能转化为电能的装置 |
| B.甲池通入CH3OH的电极反应式为CH3OH-6e-+2H2O=CO32-+8H+ |
| C.反应一段时间后,向乙池中加入一定量Cu(OH)2固体,能使CuSO4溶液恢复到原浓度 |
| D.甲池中消耗280 mL(标准状况下)O2,此时丙池中理论上产生1.45 g固体 |