下列相关反应的离子方程式书写正确的是
| A.浓盐酸与铁屑反应:2Fe+6H+=2Fe3++3H2↑ |
| B.钠与硫酸铜溶液反应:2Na+Cu2+==Cu+2Na+ |
| C.向硫酸铝溶液中加入过量氨水:Al3+ + 3OH-=Al(OH)3↓ |
| D.将铜片放入足量稀硝酸中:3Cu + 8H++ 2NO3- = 3Cu2+ + 2NO↑+ 4H2O |
化学中常用图象直观地描述化学反应的进程或结果(图④纵坐标表示难溶物达到饱和时的浓度)。下列对图象描述正确的是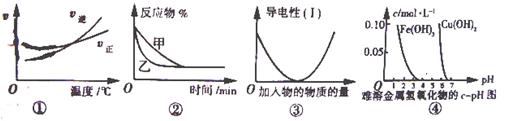
A.根据图①可判断可逆反应A2(g) +3B2(g) 2AB3(g)的△H>0 2AB3(g)的△H>0 |
B.图②可表示压强对可逆反应2A(g) +2B(g) 3C (g) + D(s)的影响,乙的压强大 3C (g) + D(s)的影响,乙的压强大 |
| C.图③可表示向乙酸溶液中通入氨气至过量的过程中溶液导电性的变化 |
D.根据图④,若除去CuSO4溶液中的 Fe3+可采用向溶液中加入适量CuO,至pH在4左右 Fe3+可采用向溶液中加入适量CuO,至pH在4左右 |
用NaOH溶液吸收二氧化硫,将所得的混合液进行电解循环再生,这种新工艺叫再生循环脱硫法。其中阴阳膜组合循环再生机理如下图,则下列说法不正确的是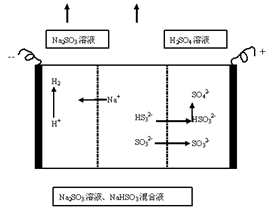
| A.阴极区电极反应式为:2H++2e-=H2↑ |
| B.该过程中的副产品主要为H2SO4溶液 |
| C.阳极室内HSO3-.SO32-被氧化为SO42- |
| D.10L 2mol/L NaOH溶液最多吸收标准状况下224L SO2 |
下列有关结论正确的是
| A.T℃时,Ba(OH)2溶液中c(H+)·c(OH-)=10-12,向pH=8的该溶液中加入等体积pH=4的盐酸,则混合溶液的pH=7 |
| B.pH相等的硫酸.盐酸.醋酸,都稀释1000倍,稀释后,pH最大的是醋酸 |
| C.0.2mol/L的HA溶液与0.1mol/L的NaOH溶液等体积混合,混合液在常温时pH一定小于7 |
| D.在0.1mol/L的硫酸氢铵溶液中各离子浓度关系是:c(H+)>c(SO42-)> c(NH4+)> c(OH-) |
用NA表示阿伏伽德罗常数的值,下列说法正确的是
| A.100mL 1mol·L-1的Na2CO3溶液中离子总数为0.3NA |
| B.若一筒120g的墨粉能打a个字,则平均每个字约含有10NA/a个碳原子 |
| C.在101kPa时,0.1NA个H2分子完全燃烧生成液态水,放出akJ热量,表示氢气燃烧的热化学方程式为:2H2(g)+O2 (g) = 2H2O (l);△H=" +20a" kJ·mol-1 |
| D.常温下28g 14CO含有14NA个电子 |
下列所列各组物质中,物质之间通过一步反应就能实现如下图所示转化的是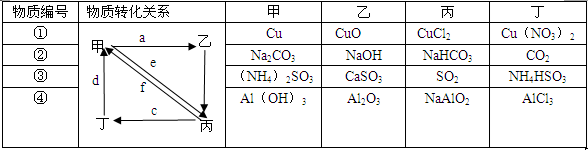
| A.①②③④ | B.①②③ | C.①③④ | D.②④ |