五种短周期元素X、Y、Z、W、Q(X、Y、Z、W、Q分别代表元素符号)在周期表中的位置如图所示。下列说法中,不正确的是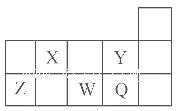
| A.X的气态氢化物与Q的气态氢化物相遇会产生白烟 |
| B.元素的非金属性:Y>Q,同浓度的氢化物水溶液的酸性:HY<HQ |
| C.形成简单离子的半径从小到大的顺序是:Y- <Q- <W2- |
| D.Z的最高价氧化物可溶于水,也能溶于强碱溶液 |
一定条件下,可逆反应:X(g) + 3Y(g) 2Z(g),若X、Y、Z的起始浓度分别为c1、c2、c3(均不为零),反应达到平衡时, X、Y、Z的浓度分别为0.1mol•L-1、0.3 mol•L-1、0.08 mol•L-1,则下列判断不正确的是()
2Z(g),若X、Y、Z的起始浓度分别为c1、c2、c3(均不为零),反应达到平衡时, X、Y、Z的浓度分别为0.1mol•L-1、0.3 mol•L-1、0.08 mol•L-1,则下列判断不正确的是()
| A.c1∶c2="=" 1∶3 | B.平衡时,Y和Z生成速率之比为3∶2 |
| C.X、Y的转化率不相等 | D.c1的取值范围为0< c1< 0.14 mol•L-1 |
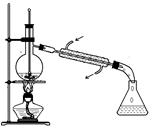
如图所示为实验室中完成不同的化学实验所选用的装置或进行的操作,其中没有明显错误的
| A 测定中和热 |
B 用石灰石和稀盐酸制取CO2 |
C 蒸馏石油 |
D 配制溶液中转移溶液 |
 |
 |
 |
 |
常温下,pH = 12的NaOH溶液与pH =1的HC1溶液按一定比例混合,所得溶液pH =2,则NaOH溶液与HC1溶液的体积比为
| A.9:2 | B.2:9 | C.1:9 | D.10:1 |
已知:(NH4)2CO3(s)=NH4HCO3(s)+NH3(g) △H =" +" 74.9 kJ·mol-1,下列说法中正确的是
| A.该反应中熵变、焓变皆大于0 |
| B.该反应是吸热反应,因此一定不能自发进行 |
| C.碳酸盐分解反应中熵增加,因此任何条件下所有碳酸盐分解一定自发进行 |
| D.能自发进行的反应一定是放热反应,不能自发进行的反应一定是吸热反应 |
为探究钢铁的吸氧腐蚀原理设计了如图所示装置,下列有关说法中错误的是 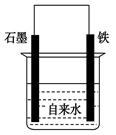
| A.正极的电极方程式为:O2+2H2O+4e-===4OH- |
| B.将石墨电极改成Mg电极,难以观察到铁锈生成 |
| C.若向自来水中加入少量NaCl(s),可较快地看到铁锈 |
| D.向铁电极附近吹入O2比向石墨电极附近吹入O2,铁锈出现得快 |