下列有关实验操作的叙述中,正确的是
| A.向沸水中滴加过量饱和氯化铁溶液并不断搅拌,制取氢氧化铁胶体 |
| B.某溶液中加入盐酸能产生使澄清石灰水变浑浊的气体,则该溶液一定含CO32- |
| C.向含Fe2+的溶液中滴加KSCN溶液,溶液不变色,滴加氯水后溶液显红色 |
| D.用量筒取5.0mL10 mol·L-1H2SO4溶液于50mL容量瓶中,直接加水稀释至刻度 |
已知下列热化学方程式:
Zn(s)+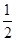 O2(g)==="ZnO(s)" ΔH1=-351.1 kJ/mol Hg(l)+
O2(g)==="ZnO(s)" ΔH1=-351.1 kJ/mol Hg(l)+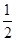 O2(g)==="HgO(s)" ΔH2=-90.7 kJ/mol
O2(g)==="HgO(s)" ΔH2=-90.7 kJ/mol
由此可知Zn(s)+HgO(s)===ZnO(s)+Hg(l)ΔH3,其中ΔH3的值是()
| A.-441.8 kJ/mol | B.-254.6 kJ/mol | C.-438.9 kJ/mol | D.-260.4 kJ/mol |
下列热化学方程式书写正确的是(ΔH的绝对值均正确) ( )
| A.C2H5OH(l)+3O2(g)===2CO2(g)+3H2O(g)ΔH=+1 367.0 kJ·mol-1(反应热) |
| B.NaOH(aq)+HCl(aq)===NaCl(aq)+H2O(l)ΔH=+57.3 kJ·mol-1(中和热) |
| C.S(s)+O2(g)===SO2(g)ΔH=-296.8 kJ·mol-1(反应热) |
| D.2NO2===O2+2NO ΔH=+116.2 kJ·mol-1(反应热) |
下列描述中,不符合生产实际的是( )
| A.电解熔融的氧化铝制取金属铝,用铁作阳极 |
| B.电解法精炼粗铜,用纯铜作阴极 |
| C.电解饱和食盐水制烧碱,用涂镍碳钢网作阴极 |
| D.在镀件上电镀锌,用锌作阳极 |
镍镉(Ni—Cd)可充电电池在现代生活中有广泛应用。已知某镍镉电池的电解质溶液为KOH溶液,其充、放电按下式进行:Cd + 2NiOOH + 2H2O Cd(OH)2 + 2Ni(OH)2。有关该电池的说法正确的是:
Cd(OH)2 + 2Ni(OH)2。有关该电池的说法正确的是:
| A.充电时阳极反应:Ni(OH)2-e- + OH- ="NiOOH" + H2O |
| B.充电过程是化学能转化为电能的过程 |
| C.放电时负极附近溶液的碱性不变 |
| D.放电时电解质溶液中的OH -向正极移动 |
可逆反应:2NO2 2NO+O2在恒温恒容密闭容器中反应,达到平衡状态的标志是:()
2NO+O2在恒温恒容密闭容器中反应,达到平衡状态的标志是:()
①单位时间内生成n molO2的同时生成2n molNO2②单位时间内生成n molO2的同时生成2n mol NO ③用NO2、NO、O2 的物质的量浓度变化表示的反应速率的比为2 : 2 : 1的状态 ④混合气体的颜色不再改变的状态⑤混合气体的密度不再改变的状态⑥混合气体的平均相对分子质量不再改变的状态
| A.①④⑥ | B.②③⑤ | C.①③④ | D.①②③④⑤⑥ |