氯及其化合物是中学化学中的重要研究对象之一。
(1)在实验室中常用二氧化锰和浓盐酸制取氯气,写出有关反应的离子方程式______________________;
(2)实验室也可以利用如下反应制取氯气:KClO3+6HCl(浓)=KCl+3Cl2↑+3H2O。若用该反应制取标准状况下1.344 L氯气,反应过程中转移电子的物质的量为_________;
(3)某同学用排空气法收集一瓶氯气并进行氯气与铁反应的实验:取一根细铁丝,用砂纸将铁丝擦至光亮,用坩埚钳夹住,在酒精灯上烧至红热,铁丝保持红热,然后立即伸入充满氯气的集气瓶中,观察到的现象是______________________。向反应后的集气瓶中加入适量的蒸馏水,振荡,然后向所得溶液中滴加亚硫酸钠溶液,再滴加氯化钡溶液发现溶液变浑浊。写出上述反应的离子方程式:___________________ 、_____________________。
过碳酸钠是一种有多用途的新型氧系漂白剂,化学式可表示为aNa2CO3·bH2O2。现将一定质量的过碳酸钠粉末溶于水配成稀溶液,再向其中加入适量MnO2粉末,充分反应后生成672mL气体(标准状况)。反应后的混合物经过滤、洗涤后,将滤液和洗涤液混合并加水配成100mL溶液A。现向三份体积为10mL、浓度为cmol/L的稀硫酸中分别逐滴滴入溶液A,边滴边振荡,充分反应后,测得实验数据如下表所示:
| 实验序号 |
Ⅰ |
Ⅱ |
Ⅲ |
| 滴加溶液A的体积/mL |
5.0 |
10.0 |
15.0 |
| 生成气体的体积/mL(标准状况) |
44.8 |
89.6 |
112 |
⑴稀硫酸的物质的量浓度c=mol/L。
⑵计算确定过碳酸钠的化学式。
⑶工业上常以所含活性氧的质量分数[w(活性氧)=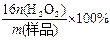 ]来衡量过碳酸钠产品的优劣,13%以上者为优等品。
]来衡量过碳酸钠产品的优劣,13%以上者为优等品。
现将0.2g某厂家生产的过碳酸钠样品(所含杂质不参与后面的氧化还原反应)溶于水配成溶液,加入15.0mL 1mol/L硫酸,再加入足量KI,摇匀后置于暗处,充分反应后,加入少量淀粉试液,用0.1mol/L Na2S2O3溶液滴定到蓝色恰好消失时,共消耗33.00mL,试计算判断该样品是否为优等品。(已知:2Na2S2O3+I2=Na2S4O6+2NaI)
有机物A(分子式C6H10O3)是合成某种隐形眼镜材料的单体,A可发生如下变化:
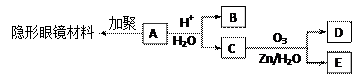 |
已知:Ⅰ.物质B是最简单的二元醇,可用作汽车发动机抗冻剂;物质D不能发生银镜反应,但能与NaHCO3溶液反应放出气体。
Ⅱ.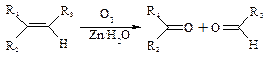
回答下列问题:
⑴隐形眼镜材料的结构简式为;
⑵写出物质B在铜催化下与O2反应的化学方程式;
⑶与C互为同分异构体,分子为链状的酯类物质共有种;
⑷请设计合理方案,用物质D制取乙二酸(其他无机原料自选,用反应流程图表示,并注明必要的反应条件)。
例如:
通常情况下空气中CO2的体积分数为0.030%,当空气中CO2的体积分数超过0.050%时,会引起明显的温室效应。为减小和消除CO2对环境的影响,一方面世界各国都在限制其排放量,另一方面科学家加强了对CO2创新利用的研究。
⑴目前,用超临界CO2(其状态介于气态和液态之间)代替氟利昂作致冷剂已成为一种趋势,这一做法对环境的积极意义在于。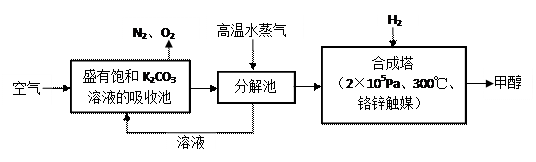 ⑵最近有科学家提出“绿色自由”构想:把空气吹入碳酸钾溶液,然后再把CO2从溶液中提取出来,经化学反应后使之变为可再生燃料甲醇。“绿色自由”构想技术流程如下:
⑵最近有科学家提出“绿色自由”构想:把空气吹入碳酸钾溶液,然后再把CO2从溶液中提取出来,经化学反应后使之变为可再生燃料甲醇。“绿色自由”构想技术流程如下:
①分解池中反应的化学方程式为。
②在合成塔中,若有4.4kg CO2与足量H2恰好完全反应,可放出4947kJ的热量,试写出合成塔中发生反应的热化学方程式。
⑶李明同学拟用沉淀法测定空气中CO2的体积分数,他查得CaCO3、BaCO3的溶度积(Ksp)分别为4.96×10-9、2.58×10-9。
李明应该选用的试剂是,实验时测定的数据除空气的体积外,还需要测定。
金属钛(Ti)因其硬度大、熔点高、常温时耐酸碱腐蚀而被广泛用作高新科技材料,被誉为“未来金属”。以钛铁矿(主要成分FeTiO3,钛酸亚铁)为主要原料冶炼金属钛同时获得副产品甲的工业生产流程如下:
回答下列问题:
⑴ 钛铁矿和浓硫酸反应的产物之一是TiOSO4,反应中无气体生成。副产品甲是。
⑵ 上述生产流程中加入Fe屑的目的是,检验副产品甲是否变质的实验方法是
。
⑶ 上述生产流程中所得到的金属钛中混有少量杂质,可加入溶解后除去。
⑷ 最近,用熔融法直接电解中间产品乙制取金属钛获得成功。写出电解乙制取金属钛的化学方程式
。
汽车内燃机工作时产生的高温会引起N2和O2的反应:N2(g)+O2(g) 2NO(g),是导致汽车尾气中含有NO的原因之一。某同学为控制污染,对该反应进行研究。
2NO(g),是导致汽车尾气中含有NO的原因之一。某同学为控制污染,对该反应进行研究。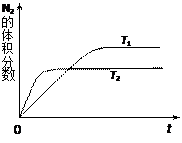
⑴右图表示在T1、T2两种不同温度下,一定量的NO发生分解过程中N2的体积分数随时间变化的图像,根据图像判断反应N2(g)+O2(g) 2NO(g)为(填“吸热”或“放热”)反应。
2NO(g)为(填“吸热”或“放热”)反应。
⑵2000℃时,向容积为2L的密闭容器中充入10molN2与5mol O2,达到平衡后NO的物质的量为2mol,则2000℃时该反应的平衡常数K=。该温度下,若开始时向上述容器中充入N2与O2均为1 mol,则达到平衡后N2的转化率为。
⑶为避免汽车尾气中的有害气体对大气的污染,给汽车安装尾气净化装置。净化装置里装有含Pd等过渡元素的催化剂,气体在催化剂表面吸附与解吸作用的机理如下图所示。
写出上述变化中的总化学反应方程式:。