根据表中信息,判断下列叙述中正确的是
| 序号 |
氧化剂 |
还原剂 |
其他反应物 |
氧化产物 |
还原产物 |
| ① |
Cl2 |
FeBr2 |
/ |
|
Cl- |
| ② |
KClO3 |
浓盐酸 |
/ |
Cl2 |
|
| ③ |
KMnO4 |
H2O2 |
H2SO4 |
O2 |
Mn2+ |
A.表中①组的反应可能有一种或两种元素被氧化
B.氧化性强弱的比较:KClO3>Fe3+>Cl2>Br2
C.表中②组反应的还原产物是KCl,电子转移数目是6e-
D.表中③组反应的离子方程式为2MnO4-+3H2O2+6H+=2Mn2++4O2↑+6H2O
下列各个装置中能组成原电池的是
某原电池总反应为2Fe3++Fe=3Fe2+,不能实现该反应的原电池是
| A.正极为Cu,负极为Fe,电解质溶液为FeCl3 |
| B.正极为Cu,负极为Fe,电解质溶液为Fe(NO)3 |
| C.正极为Fe,负极为Zn,电解质溶液为Fe2(SO4)3 |
| D.正极为Ag,负极为Fe,电解质溶液为Fe2(SO4)3 |
如图所示是Zn和Cu形成的原电池,其实验兴趣小组做完实验后,在读书卡上的记录如下,则卡片上的描述合理的是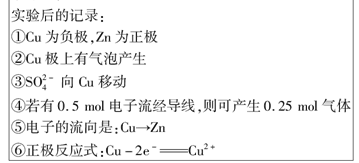
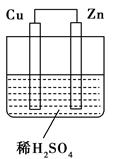
| A.①②③ | B.②④ | C.④⑤⑥ | D.③④⑤ |
下列说法正确的是
| A.流水、风力是一次能源,电力、蒸汽是二次能源 |
| B.普通锌锰电池是一次电池,碱性锌锰电池是二次电池 |
| C.铅蓄电池是一次电池,氢氧燃料电池是二次电池 |
| D.同周期元素形成的简单离子中,原子序数越大的离子半径越小 |
下列物质间的反应,其能量变化符合下图的是
| A.灼热的碳和二氧化碳的反应 |
| B.Ba (OH)2·8H2O晶体和NH4Cl晶体混合 |
| C.生石灰和水反应 |
| D.CaCO3分解 |