有一种细菌在酸性水溶液、氧气存在下,可以将黄铜矿(主要成分是CuFeS2,含少量杂质SiO2)氧化成硫酸盐。运用该原理生产铜和绿矾(FeSO4·7H2O)的流程如下: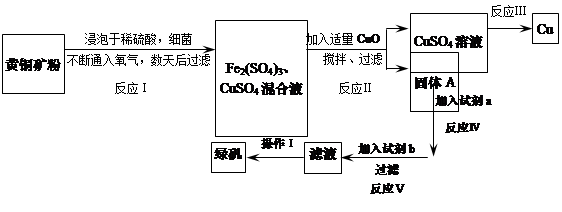
回答下列问题:
(1)已知:
| |
Fe2+ |
Cu2+ |
Fe3+ |
| 开始转化成氢氧化物沉淀时的pH |
7.6 |
4.7 |
2.7 |
| 完全转化成氢氧化物沉淀时的pH |
9.6 |
6.7 |
3.7 |
(1)加入CuO将溶液的pH调节到约为4,结合平衡移动原理解释该操作的原因 。
(2)写出能实现反应Ⅲ的化学方程式 。
(3)试剂b为 。
(4)欲从滤液中获得绿矾晶体,操作Ⅰ应为浓缩、 、 。
(5)反应Ⅰ的化学方程式 。
W、X、Y、Z四种短周期元素在周期表中的位置如图所示,其中Y与钠元素和氢元素均可形成原子个数1:1和1:2的化合物。
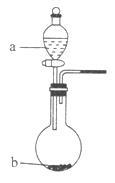
请回答下列问题。
(1)H2Y2的电子式为______________________,Z在周期表中的位置___________________。
(2)在图中,b的pH约为7,且含有Fe2+和淀粉KI的水溶液,a为H2Y2的水溶液,旋开分液漏斗旋钮,观察到烧瓶中溶液呈蓝色并有红褐色沉淀生成。当消耗2molI-时,共转移3mol电子,该反应的离子方程式是_________________________。
(3)已知:298K时,金属钠与Y2气体反应,若生成1molNa2Y固体时,放出热量414kJ;若生成1molNa2Y2固体时,放出热量511kJ。则由Na2Y固体与Y2气体反应生成Na2Y2固体的热化学方程式为_____________。
(4)有人设想利用原电池原理以气体Z2和氢气制备一种重要的化工原料,同时获取电能。假设这种想法可行,用石墨作电极材料,用稀盐酸作电解溶液,则通入Z2的电极为原电池的___________极,其电极反应式为____________________。
中学常见反应的化学方程式是A+B→X+Y+H2O(未配平,反应条件略去),其中A、B的物质的量之比为了1:4。请回答:
(1)若Y是黄绿色气体,则Y的电子式是 ,该反应的离子方程式是 。
(2)若A为非金属单质,构成它的原子核外最外层电子数是次外层电子数的2倍,B的溶液为某浓酸,则反应中氧化剂与还原剂的物质的量之比是 。
(3)若A为金属单质,常温下A在B的浓溶液中“钝化”,且A可溶于X溶液中。
①A元素在周期表中的位置是 (填所在周期和族);Y的化学式是 。
②含amol X的溶液溶解了一定量A后,若溶液中两种金属阳离子的物质的量恰好相等,则被还原的X是
mol。
(4)若A、B、X、Y均为化合物。向A溶液中加入硝酸酸化的AgNO3溶液,产生白色沉淀;B的焰色为黄色。则A与B按物质的量之比1∶4恰好反应后,溶液中离子浓度从大到小的顺序是 。
金刚石、SiC具有优良的耐磨、耐腐蚀特性,应用广泛。
(1)碳与短周期元素Q的单质化合仅能生成两种常见气态化合物,其中一种化合物R为非极性分子。碳元素在周期表中的位置是 ,Q是 ,R的电子式为 ;
(2)一定条件下,Na还原CCl4可制备金刚石,反应结束冷却至室温后,回收其中的CCl4的实验操作名称为 ,除去粗产品中少量钠的试剂为 ;
(3)碳还原SiO2制SiC,其粗产品中杂质为Si和SiO2.现将20.0g SiC粗产品加入到过量的NaOH溶液中充分反应,收集到0.1mol氢气,生成氢气的离子方程式为 ,将滤液稀释到1L,若所得Na2SiO3的物质的量浓度为0.17mol· L-1,则SiC的纯度为_____________;
(4)下列叙述正确的有 (填序号)
①Na还原CCl4的反应、Cl2与H2O的反应均是置换反应
②Na2SiO3溶液与SO3的反应可用于推断Si与S的非金属性强弱
③钠、锂分别在空气中燃烧,生成的氧化物中阴阳离子数目比均为1∶2
④水晶、干冰熔化时克服粒子间作用力的类型相同
位于短周期的四种主族元素A、B、C、D原子序数依次增大,已知A、C位于同一主族,A在周期表中原子半径最小,B、D的最外层电子数相等,且B、D的原子序数之和为A、C原子序数之和的两倍。根据你的推断完成下列问题:
(1)写出由上述元素形成的具有漂白作用的四种物质的化学式___________、___________、___________、___________。
(2)C与D形成D的最低价化合物的电子式:______________________。
(3)仅由B、C、D三种元素形成的一种盐,溶于水后呈碱性,请用一个离子方程式表示其呈碱性的原因:____________________________________________。
现有下列仪器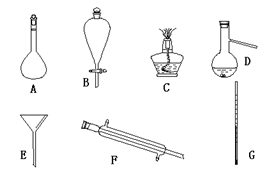
(1)海水蒸馏是由海水获得淡水的常用方法之一,在实验室组成一套蒸馏装置肯定需要上述仪器中的一部分,按照实验仪器由下向上,从左到右的顺序,这些仪器依次是 ;还缺少的玻璃仪器是 (填仪器名称);仪器F的冷凝水应当从 口流出。
(2)海带等藻类物质经过处理后可以得到碘水,欲从碘水中提取碘需要上述仪器中的(填字母) ;该仪器名称为 ;向碘水中加入四氯化碳以提取碘单质的实验操作称为 ;静置分层后,单质碘主要溶解在 (填溶剂名称)中,该层此时的颜色为