下列离子方程式正确的是
| A.向Ca(HCO3)2溶液中加入过量NaOH溶液:Ca2+ + HCO3-+ OH-=CaCO3↓+ H2O |
B.用石墨电极电解饱和食盐水:2H++2Cl- Cl2↑+H2↑ Cl2↑+H2↑ |
| C.AlCl3和过量氨水反应:Al3++3OH-=Al(OH)3↓ |
| D.向淀粉碘化钾溶液中滴加稀硫酸,在空气中放置一段时间后变蓝:4H+ + 4I- + O2 =2I2 + 2H2O |
据报导,我国某些城市的酸雨严重,为改变这一状况,某市正准备推广使用的清洁能源,下列所列能源不是清洁能源的是()
| A.太阳能 | B.石油 | C.天然气 | D.酒精 |
农药波尔多液不能用铁制容器盛放,是因为铁能与该农药中的硫酸铜起反应。该反应中,铁是()
| A.氧化剂 | B.被还原 | C.还原剂 | D.氧化产物 |
我国近海海域海水中一些元素含量普遍超标,富营养化十分严重。经常发生“赤潮”现象。下列生活用品中能引起“赤潮”的是()
| A.肥皂 | B.含磷洗涤剂 | C.加酶洗衣粉 | D.化妆品 |
I2在KI溶液中存在下列平衡: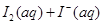

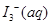 某I2、、KI混合溶液中,
某I2、、KI混合溶液中,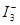 的物质的量浓度c(
的物质的量浓度c(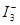 )与温度T的关系如图所示(曲线上任何一点都表示平衡状态)。下列说法正确的是
)与温度T的关系如图所示(曲线上任何一点都表示平衡状态)。下列说法正确的是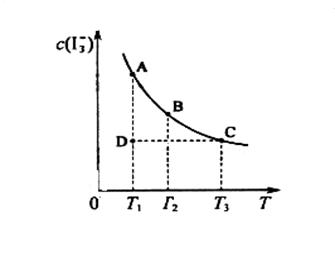
A.反应 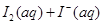  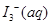 △H>0 △H>0 |
B.若温度为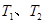 ,反应的平衡常数分别为 ,反应的平衡常数分别为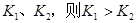 |
C.若反应进行到状态D时,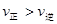 |
| D.状态A与状态B相比,状态A的c(I2)大 |
一定温度和一定体积的条件下反应:A2(s)+2B2(g)  2AB2(g) 达到平衡状态的标志是 ( )
2AB2(g) 达到平衡状态的标志是 ( )
| A.V正(B2)==V逆(AB2) |
| B.容器内的总压强不随时间而变化 |
| C.单位时间内生成1molAB2的同时,消耗1mol的B2 |
| D.气体密度不再随时间变化而变化 |