下列说法不正确的是
| A.乙酸乙酯在H218O中水解,产物乙醇中将含有18O同位素 |
| B.乙醇与水互溶,这与乙醇和水分子之间能形成氢键有关 |
| C.质谱和核磁共振不仅可用于有机小分子结构的分析,还可用于蛋白质结构的研究 |
| D.Na2SO4·10H2O失水时吸热,结晶时放热,因而该晶体可作为储热材料实现化学能与热能的相互转换 |
“茶倍健”牙膏中含有茶多酚,期中没食子儿茶素(EGC)的结构如下图所示。关于EGC的下列叙述中正确的是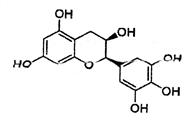
A.分子式为C15H12O7
B.EGC可在强碱的醇溶液中发生消去反应
C.1molEGC最多消耗6molNaOH
D.1molEGC可与4molBr2发生取代反应
下列离子方程式书写不正确的是
| A.向H2SO4酸化的KI溶液中滴加H2O2:2I-+H2O2+2H+=I2+2H2O |
| B.小苏打治疗胃酸过多:H++HCO3-=H2O+CO2↑ |
C.氯气溶于水:Cl2+H2O H++Cl-+HClO H++Cl-+HClO |
| D.检验溴乙烷中含有的溴元素:CH3CH2Br+Ag+=AgBr↓+CH3CH2+ |
已知A、B为单质,C为化合物。能实现上述转化关系的是
①若C溶于水后得到强碱溶液,则A可能是Na
②若C溶液遇Na2CO3放出CO2气体,则A可能是H2
③若C溶液中滴加KSCN溶液显红色,则B可能为Fe
④若C溶液中滴加NaOH溶液有蓝色沉淀生成,则B可能为Cu
A. ①② B. ③④ C. ①③ D. ②④
下列实验“操作和现象”与“结论”都正确的是
| 操作和现象 |
结论 |
|
| A |
切开金属钠,钠表面的银白色会逐渐褪去 |
Na在空气中会生成Na2O2 |
| B |
铝箔插入浓硝酸中,无明显现象 |
铝与浓硝酸不反应 |
| C |
SO2通入酸性KMnO4溶液,溶液褪色 |
SO2具有漂白性 |
| D |
将充满NO2的试管倒立在水中,试管内液面约上升至试管容积的2/3处;缓慢通入O2,轻轻晃动试管,至液体基本上充满试管 |
从原料的充分利用和减少污染物的排放等方面考虑,该实验对工业生产硝酸有重要启示 |
钯的化合物氯化钯可用来检测有毒气体CO,常温发生反应的化学方程式为:
CO+PdCl2+H2O=CO2+Pd↓+2HCl下列说法正确的是
| A.氧化性:PdCl2>CO2 | B.反应中PdCl2被氧化 |
| C.生成22.4LCO2时,转移的电子为2mol | D.CO气体只有在高温下才能表现还原性 |