在浓CaCl2溶液中通入NH3和CO2,可以制得纳米级碳酸钙(粒子直径在1~10nm之间).下图所示A~E为实验室常见的仪器装置(部分固定夹持装置略去),请根据要求回答问题.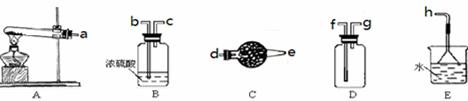
(1)实验室制备NH3的反应方程式:_______________________________;
(2)实验室制取、收集干燥的NH3,需选用上述仪器装置的接口连接顺序是(选填字母):a接 , 接 , 接h;
(3)向浓CaCl2溶液中通入NH3和CO2气体制纳米级碳酸钙时,应先通入的气体是 ,试写出制纳米级碳酸钙的离子方程式 ;
(4)在浓CaCl2溶液和NH3用量正确的情况下,CO2不足或过量都会导致纳米级碳酸钙产量下降,若CO2过量溶液中大量存在的离子有(不考虑弱电解质的电离和盐类水解产生的少量离子)________________,
(5)取反应后去除了CaCO3的溶液分别做以下实验,下列实验判断合理的是:_________.
| A.滴加少量Na2CO3溶液,若有沉淀说明CO2一定不足 |
| B.滴加少量盐酸,若有气泡,CO2一定过量 |
| C.测量溶液pH,若大于7,CO2一定不足量 |
| D.滴加少量BaCl2溶液,若无沉淀,CO2一定没有过量 |
(6)试设计简单的实验方案,判断所得碳酸钙样品颗粒是否为纳米级
(11分)A、B、C、D、E可能是NH4Cl、Ba(OH)2、KCl、K2SO4、(NH4)2SO4无色溶液中的一种,将它们两两混合时产生的现象是:
①A和B混合后产生白色沉淀,加热后无明显现象。
②B和C混合也产生白色沉淀,加热后有气体产生,气体使湿润的红色石蕊试纸变蓝。
③B和E混合后无沉淀,但加热后也产生使湿润的红色石蕊试纸变蓝的气体。
④D和任何一种溶液混合后,都无明显变化。根据上述现象,回答下列问题:
(1)A是____, B是___,C是________,D是________,E的电子式_______。
(2)写出有关反应的离子方程式:
A+B:________________________________________________;
B+C:_________________________________________________;
B+E:_____________________________________________。
氮化硅(氮显-3价,硅显+4价)是一种高温陶瓷材料,它的硬度大、熔点高、化学性质稳定,工业上曾普遍采用高纯硅与纯氮在1300 ℃时反应获得。
(1)写出N的原子结构示意图________和氮化硅的化学式________。
(2)氮化硅陶瓷抗腐蚀能力强,除氢氟酸外,它不与其他无机酸反应。试推测该陶瓷被氢氟酸腐蚀的化学方程式____________________________。
(3)现用四氯化硅和氮气在氢气气氛保护下,加强热发生反应,可得较高纯度的氮化硅,反应的化学方程式为_____________________。
为测定一种气态烃A的化学式,取标准状况下一定体积的A置于密闭容器中,再通入一定体积的O2 ,用电火花引燃,定性实验表明产物是CO2、CO、水蒸气。相关方案及有关数据如下(图中的箭头表示气体的流向,实验前系统内的空气已排除)。
试回答:
(1)通过计算求出A的实验式(最简式)。
(2)根据所学知识,你认为气态烃A只能是哪种物质?你的根据是什么?
已知:①A是石油裂解气的主要成份,A的产量通常用来衡量一个国家的石油化工水平;②2CH3CHO+O2 2CH3COOH。现以A为主要原料合成乙酸乙酯,其合成路线如下图所示。
2CH3COOH。现以A为主要原料合成乙酸乙酯,其合成路线如下图所示。
回答下列问题:
(1)、写出A的电子式。
(2)B、D分子中的官能团名称分别是、。
(3)写出下列反应的反应类型:①,②,④。
(4)写出下列反应的化学方程式:
①;
② ;
④。
(5)现拟分离含乙酸、乙醇和水的乙酸乙酯粗产品,下图是分离操作步骤流程图。请在图中圆括号内填入适当的试剂,在方括号内填入适当的分离方法。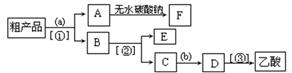
(Ⅰ)试剂a是__________,试剂b是_______________;
分离方法①是_________________,分离方法②是__________________,
分离方法③是_______________。
(Ⅱ)在得到的A中加入无水碳酸钠粉末,振荡,目的是
______。
(Ⅲ)写出C → D 反应的化学方程式 。
已知X、Y、Z都是短周期元素,它们的原子序数依次递增,X原子的电子层数与它的核外电子总数相同,而Z原子的最外层电子数是次外层电子数的三倍,Y和Z可以形成两种以上的气态化合物,则
(1)写出下列元素名称:X是________,Z是________。
(2)由Y和Z组成,且Y和Z的质量比为7∶20的化合物的分子式是________。
(3)写出由X、Y、Z中的两种元素组成,且与X2Z分子具有相同电子数的两种阴、阳离子_______和_______,其中阴离子的电子式为______________。
(4)X、Y、Z可以形成一种盐,此盐中X、Y、Z元素的原子个数比为4∶2∶3,该盐的化学式是_______________;如果向该盐溶液中加入铜和稀硫酸,溶液变蓝色,试写出离子方程式_____ __;如果将该盐固体与熟石灰混合加热,会产生一种刺激性气味的气体,试写出化学方程式__________________________________。