关于平衡常数,下列说法不正确的是
| A.平衡常数随温度的改变而改变 |
| B.使用催化剂不能改变平衡常数 |
| C.平衡常数不随反应物或生成物浓度的改变而改变 |
| D.增大压强促使平衡向正反应方向进行,则平衡常数增大 |
下列化学药品与其危险化学品图形标志不一致的一组是()
1.52 g铜镁合金完全溶解于50 mL密度为1.40 g/mL、质量分数为63%的浓硝酸中,得到NO2和N2O4的混合气体1120 mL (标准状况),向反应后的溶液中加入1.0 mol/L NaOH溶液,当金属离子全部沉淀时,得到2.54 g沉淀,下列说法不正确的是( )
| A.该合金中铜与镁的物质的量之比是2∶1 |
| B.该浓硝酸中HNO3的物质的量浓度是14.0 mol/L |
| C.NO2和N2O4的混合气体中,NO2的体积分数是80% |
| D.得到2.54 g沉淀时,加入NaOH溶液的体积是600 mL |
常温下,甲组中的某种物质能与乙组中的所有物质发生反应,甲组中的该物质是( )
| 甲组 |
①Al(OH)3 ②SiO2 ③ FeCl3溶液 ④ SO2 |
| 乙组 |
a.NaOH溶液 b.浓HNO3 c.氨水 d.氯水 e.H2O2溶液 |
A.① B.② C.③ D.④
下列有关离子方程式推理正确的是( )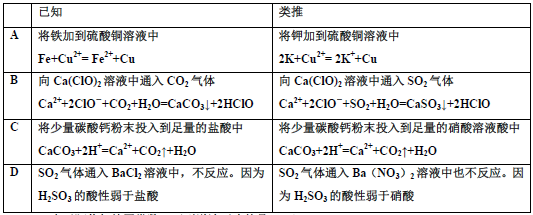
海洋中有丰富的食品、矿产资源、药物和水产资源等(如图所示),下列有关说法不正确的是( )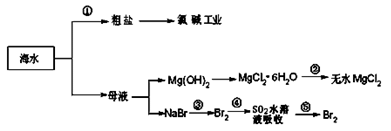
| A.从能量转换角度来看,框图中的氯碱工业是一个将电能转化为化学能的过程 |
| B.过程②中结晶出的MgCl2·6H2O要在HCl氛围中加热脱水制得无水MgCl2 |
| C.在过程③⑤中溴元素均被氧化 |
D.过程①中除去粗盐中的 、Ca2+、Mg2+、Fe3+等杂质,加入的药品顺序为:Na2CO3溶液→NaOH溶液→BaCl2溶液→过滤后加盐酸 、Ca2+、Mg2+、Fe3+等杂质,加入的药品顺序为:Na2CO3溶液→NaOH溶液→BaCl2溶液→过滤后加盐酸 |