依据氧化还原反应:2Ag+(aq)+Cu(s)=Cu2+(aq)+2Ag(s)设计的原电池如下图,回答下列问题:
(1)电极X的材料是 ,电解质溶液Y是 。
(2)银电极为电池的 极。
(3)盐桥中阳离子向 移动(填“左 ”或“右”)。
(4)外电路中电子是从 (填电极材料名称,下同)电极流向 电极。
按如图所示,两个烧杯中分别盛有足量的稀硫酸溶液和氯化铜溶液: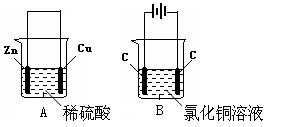
(1)A,B两个装置中,属于原电池的是(填标号)
(2)A池中,铜极为极,发生反应,(填“氧化”“还原”)电极反应式为:。
(3)B池中,左边C是极,电极反应式为:;
总反应式为。
(4)B池中当阴极产生6.4g铜时,阳极放出g气体。
有A、B、C、D四种短周期元素,它们的原子序数由A到D依次增大。,已知A和B原子有相同的电子层数,且A的L层电子数是K层电子数的两倍;,B是地壳中含量最多的元素;C元素的焰色为黄色,C的单质一般保存在煤油中;D的M层电子数为K层电子数的3倍。试根据以上叙述回答:
(1)元素名称:A ________ B __________ C __________ D ___________。
(2)写出A与B形成的化合物的电子式:______________。
(3)画出D的离子结构示意图: ___________________。
(4)B的气态氢化物稳定性比D的气态氢化物稳定性______。(填“强”、“弱”或“相同”)
(5)已知4g A的气态氢化物在氧气中完全燃烧生成液态水,放出222.5kJ热量。写出A的氢化物燃烧的热化学方程式。
现有①MgBr2②金刚石 ③NaOH ④KCl⑤干冰五种物质,按下列要求回答(填序号,每空一个答案)
(1)是共价化合物的是______,既有离子键又有共价键的物质是
(2)熔化时不需要破坏化学键的是________,熔化时需要破坏共价键的是________,熔点最高的是________。
元素X最高正化合价为+7,其气态氢化物的化学式为________。某元素R与氢形成的气态氢化物的化学式为H2R,其最高价氧化物的水化物的化学式为____________。
在实验室中做下列实验:把物质A、B按一定比例充入一个表面积为300 ,容积为2 L的球形容器,使压强为P,然后将整个容器用加热器加热到t℃时,发生如下反应:
,容积为2 L的球形容器,使压强为P,然后将整个容器用加热器加热到t℃时,发生如下反应:
2A(g)+B(g) 2C(g);H=-180 kJ·
2C(g);H=-180 kJ·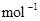
(1)若平均每分钟生成0.5 mol的C,则此反应速率可表示为v(C)=____________;若容器表面向外散热速率平均为400 J· ·
· ,为了维持恒温t℃,平均每分钟需用加热器提供________kJ的热量;
,为了维持恒温t℃,平均每分钟需用加热器提供________kJ的热量;
(2)反应过程中A(g)、B(g)、C(g)物质的量变化如图所示,根据图中所示判断下列说法正确的是________。
A.10~15 min可能是加入了正催化剂
B.10~15 min可能是降低了温度
C.20 min时可能是缩小了容器体积
D.20 min时可能是增加了B的量