在一定条件下,已达平衡的可逆反应:2A(g)+B(g)  2C(g),下列说法中正确的是 ( )
2C(g),下列说法中正确的是 ( )
A.平衡时,此反应的平衡常数K与各物质的浓度有如下关系:K=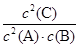 |
| B.改变条件后,该反应的平衡常数K一定不变 |
| C.如果改变压强并加入催化剂,平衡常数会随之变化 |
| D.若平衡时增加A和B的浓度,则平衡常数会减小 |
下列离子方程式中正确的是
A.向硫酸铜溶液中加入过量的NaHS溶液:Cu2++2HS- CuS↓+H2S↑ CuS↓+H2S↑ |
B.Fe3O4溶解在过量的稀硝酸中:Fe3O4+8H+ Fe2++2Fe3++4H2O Fe2++2Fe3++4H2O |
C.碳酸氢铵溶液与苛性钾溶液混和共热:NH4++OH- NH3↑+H2O NH3↑+H2O |
D.将少量SO2气体通入NaClO溶液中:SO2+2ClO-+H2O SO32-+2HClO SO32-+2HClO |
依据原电池原理,设计番茄电池并检测电流的产生,其中合理的是
A. |
B. |
C. |
D. |
下列有关钠的叙述中,错误的是
| A.钠的还原性很强,可以用来冶炼金属钛、锆、铌等 |
| B.钠的化学性质非常活泼,钠元素只能以化合态存在于自然界 |
| C.钠极易和水反应而被还原 |
| D.钠、氧化钠、氢氧化钠的焰色反应均显黄色 |
短周期元素X、Y、Z、W在元素周期表中的相对位置如下图所示。下列说法正确的是
| A.原子半径的大小顺序: r(W) >r(Z)> r(Y) |
| B.Y、Z的氢化物有可能含非极性键 |
| C.Z、W形成的化合物W显负价 |
| D.Y分别与Z、W形成的化合物全部都是非极性分子 |
工业上制备下列金属,采用的化学反应原理正确的是
A.镁:2MgO (熔融)  Mg+O2↑ Mg+O2↑ |
B.钙:CaO+C Ca+CO↑ Ca+CO↑ |
C.锰:3MnO2+4Al 3Mn+2Al2O3 3Mn+2Al2O3 |
D.汞:HgS Hg+S Hg+S |