研究NO2、、CO等大气污染气体的处理具有重要意义。
利用反应6NO2(g)+8NH3(g)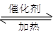 7N2(g)+12 H2O(g)可处理NO2。700℃时,向容积为2L的密闭容器中充入一定量的NO2和NH3, 反应过程中测定的部分数据见下表
7N2(g)+12 H2O(g)可处理NO2。700℃时,向容积为2L的密闭容器中充入一定量的NO2和NH3, 反应过程中测定的部分数据见下表
| 反应时间/min |
n(NO2)/mol |
n(NH3)/ mol |
| 0 |
1.20 |
1.60 |
| 2 |
0.90 |
|
| 4 |
|
0.40 |
(1)反应在2min内的平均速率为v(NH3)=
4min该反应达到平衡状态,则该反应的平衡常数K的表达式为 ,NO2的转化率为
(2) 700℃ ,将NO2与NH3以体积比1:2置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是 。
a.体系压强保持不变 b.混合气体颜色保持不变
c.体系密度保持不变 d.每消耗1 mol NO2的同时生成2 mol H2O
(3)CO可用于合成甲醇,反应方程式为CO(g)+2H2(g) CH3OH(g)。200℃时,向在一个带活塞的密闭真空容器中中充入一定量的CO和H2发生上述反应,压缩容器的容积为原来的一半,平衡将 移动(填向左,向右,不);CO的浓度将 (增大,减小,不变)
CH3OH(g)。200℃时,向在一个带活塞的密闭真空容器中中充入一定量的CO和H2发生上述反应,压缩容器的容积为原来的一半,平衡将 移动(填向左,向右,不);CO的浓度将 (增大,减小,不变)
(6分)选择下列实验方法分离物质,将分离方法的序号填在横线上。
| A.萃取分液法 | B.加热分解法 | C.结晶法 | D.分液法 E.蒸馏法 F.过滤法 |
(1)________分离饱和食盐水与沙子的混合的。
(2)________从KNO3和NaCl的混合溶液中获得KNO3。
(3)________分离水和汽油的混合物。
(4)________分离四氯化碳(沸点76.75℃)和甲苯(沸点110.6℃)的混合物。
(5)________从碘的水溶液里提取碘。
(6)________从NaCl与NH4HCO3固体混合物中得到NaCl。
(9分)有化合物:
(1)请写出丙中含氧官能团的名称:______________。
(2)请判别上述哪些化合物互为同分异构体:__________________________________。
(3)请按酸性由强到弱排列甲、乙、丙的顺序。
(10分)某烃类化合物A的质谱图表明其相对分子质量为84,红外光谱表明分子中含有碳碳双键,核磁共振氢谱表明分子中只有一种类型的氢。
(1)A的结构简式为______________,名称为___________________________________。
(2)A中的碳原子是否都处于同一平面?________(填“是”或“不是”);A分子是否存在顺反异构体________(填“是”或“否”)。
(3)已知A、B、C有如下转化关系: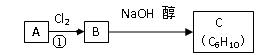
|
 ;
;
(11分)A~G是几种烃的分子球棍模型(如图),据此回答下列问题:
(1)常温下含氢量最高的气态烃是________(填字母)。
(2)能够发生加成的烃有________种。
(3)一卤代物种类最多的是________(填写字母)。
(4)写出实验室制D的化学方程式:__________________________________________。
(5)写出G发生硝化反应的化学方程式:。
(10分)乙醇分子中各化学键如图所示,则乙醇在下列反应中应断裂的键分别是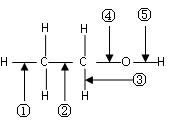
⑴.和金属钠作用时,应断裂键
⑵.和浓硫酸共热至170 ℃时,应断裂键
⑶.和乙酸、浓硫酸共热时,应断裂 键
键
⑷.在铜催化下和氧气反应时,应断裂键
⑸. 和浓硫酸共热至140 ℃时,应断裂键