将下列离子方程式改写成化学方程式:
(1)CO32—+2H+=CO2↑+H2O:
(2)Cu2++2OH—=Cu(OH)2↓:
(3)Zn+2Ag+=Zn2++2Ag:
下列轨道表示式能表示氮原子的最低能量状态的是()
A. |
B. |
C.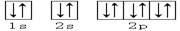 |
D. |
下列描述中,不符合生产实际的是()
| A.电解熔融的氧化铝制取金属铝,用铁作阳极 |
| B.电解法精炼铜,用纯铜作阴极 |
| C.电解饱和食盐水制烧碱,用涂镍碳钢网作阴极 |
| D.在镀件上电镀锌,用锌作阳极 |
下列过程需要通电才能进行的是( )
①电离 ②电解 ③电镀 ④电泳 ⑤电化学腐蚀
| A.①②③ | B.②④⑤ | C.②③④ | D.全部 |
根据元素周期律和物质结构的有关知识,以下有关排序错误的是()
| A.离子半径:S2->Cl->Ca2+ | B.原子半径:Ca>S>Cl |
| C.热稳定性:HCl>H2S>H2Se | D.酸性:HClO4<HBrO4<HIO4 |
在电解水制取H2和O2时,为了增强导电性,常常要加入一些电解质,最好选用()
| A.CuSO4 | B.HC1 | C.NaCl | D.NaOH |