(1)在3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O反应中,_______是氧化剂;_______是还原剂;_______元素被氧化;_______元素被还原;______是氧化产物;_______是还原产物,被还原的HNO3与参加反应的HNO3物质的量之比是___ __。用双线桥标出该反应电子转移的方向和数目。
(2)双线桥标出反应KClO3+ 6HCl=KCl + 3 Cl2↑ + 3H2O电子转移的方向和数目。
二氧化硫和氮氧化物是常用的化工原料,也会给大气带来严重污染,综合治理其污染是环境化学当前的重要研究内容之一。
(1) 新型氨法烟气脱硫技术的化学原理是采用氨水吸收烟气中的SO2,其吸收的化学反应方程式为 再用一定量的磷酸与上述吸收产物反应。该技术的优点除了能回收利用SO2外,还能得到一种复合肥料,该复合肥料可能的化学式为(只要求写一种)。
再用一定量的磷酸与上述吸收产物反应。该技术的优点除了能回收利用SO2外,还能得到一种复合肥料,该复合肥料可能的化学式为(只要求写一种)。
(2) 工业上生产硫酸时,将SO2氧化为SO3是关键一步。
① 某温度下,SO2(g)+1/2O2(g) SO3(g);△H=" —98" kJ· mol—1。开始时在10L的密闭容器中加入4.0mol SO2(g)和5.0molO2(g),当反应
SO3(g);△H=" —98" kJ· mol—1。开始时在10L的密闭容器中加入4.0mol SO2(g)和5.0molO2(g),当反应 达到平衡时混合气体的总物质的量为8.0mol,该温度下平衡常数K=。
达到平衡时混合气体的总物质的量为8.0mol,该温度下平衡常数K=。
② 一定条件下,向一带活塞的密闭容器中充入2molSO2和1molO2,发生下列反应:2SO2(g)+O2(g) 2SO3(g)达到平衡后改变下述条件,SO3的体积分数变大的是
2SO3(g)达到平衡后改变下述条件,SO3的体积分数变大的是
| A.保持温度和容器压强不变,充入2mol SO3 |
| B.保持温度和容器体积不变,充入2mol N2 |
| C.保持温度和容器体积不变,充入0.5mol SO2和0.25mol O2 |
| D.升高温度 |
E、移动活塞压缩气体
(3) 某人设想以如图所示装置用电化学原理生产硫酸,通入O2的一极的电极为极; 写出通入SO2的电极的电极反应式:。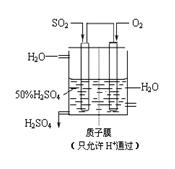
A、B、C是三种常见短周期元素的单质。常温下D为无色液体,E是一种常见的温室气体,F是由两种短周期元素构成的离子化合物,其转化关系如图 (反应条件和部分产物略去)。试回答: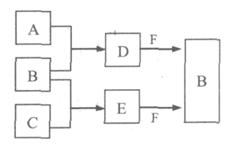
(1) F的电子式是。
(2)写出E与F反应生成B的化学方程式,并用双线桥标出电子转移的方向与数目
(3) 单质X和B或D均能反应生成黑色固体Y,Y与盐酸反应的离子方程式是。若固体恰好溶解,则所得溶液呈性。
(4) 物质Z常用于对空气进行杀菌、净化和水果保鲜等。Z和B的组成元素相同,Z分子中各原子最外层电子数之和为18。Z和酸性碘化钾溶液反应生成B和碘单质,反应的离子方程式是。
(5) 取0.3 mol F与足量D充分混合后,所得溶液中再通入0.4 mol E充分反应,最后得到产物的物质的量比为。(不考虑水解)
(6) E的大量排放会引发很多环境问题。有科学家提出,用E和H2合成CH3OH和H2O,对E进行综合利用。25℃,101 kPa时,该反应的热化学方程式是。
(已知甲醇的燃烧热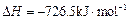 ,氢气的燃烧热
,氢气的燃烧热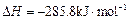 )
)
离子推断题
某待测液中可能含有Mg2+、NH4+、Ba2+、CO32-、SO42-、AlO2-等离子,各取少量进行如下实验:
(1)加足量NaOH溶液并加热,过程中无沉淀也无气体生成,可排除
离子大量存在;
(2)加入过量的稀盐酸,先出现白色沉淀,后来沉淀逐渐溶解消失。继续加稀硫酸,又出现白色沉淀。可肯定含有 离子,并排除
离子大量存在。
 某化学兴趣小组模拟工业上从铝土矿(主要成分是
某化学兴趣小组模拟工业上从铝土矿(主要成分是 ,含
,含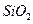 、
、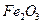 等杂质)中提取氧化铝的工艺做实验,流程如下:
等杂质)中提取氧化铝的工艺做实验,流程如下: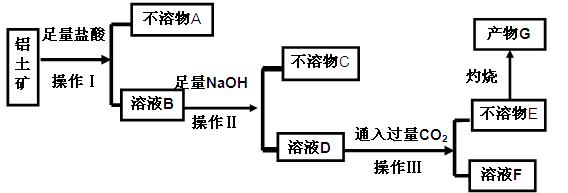

 请回答下列问题:
请回答下列问题: (1)操作Ⅰ、Ⅱ、Ⅲ的名称为 。
(1)操作Ⅰ、Ⅱ、Ⅲ的名称为 。 (2)不溶物C是 (填化学式),不溶物E是 (填化学式),写出B→D反应的离子方程式 。
(2)不溶物C是 (填化学式),不溶物E是 (填化学式),写出B→D反应的离子方程式 。 (3)溶液F中含碳元素溶质的主要成份是 (填化学式),说出它的一种用途 。
(3)溶液F中含碳元素溶质的主要成份是 (填化学式),说出它的一种用途 。
按要求进行书写:
(1)氯化铝溶液与足量的氨水反应的离子方程式:
(2)用氯化铁溶液蚀刻印刷铜电路板反应的离子方程式:
(3)解释装氢氧化钠溶液的试剂瓶不能用磨口玻璃塞原因的化学方程式:
(4)等物质的量的二氧化硫与氯 气同时通入水中反应的化学方程式:
气同时通入水中反应的化学方程式: