现有以下物质:①KCI晶体②食盐水③液态的醋酸④I2⑤BaSO4固体⑥蔗糖(C12H22O11 )⑦酒精(C2H5OH)⑧熔融的NaOH⑨K2O⑩SO2。请回答下列问题:
(1)以上物质中能导电的是_________________(用序号)。
(2)以上物质属于电解质的是_________________(用序号)。
(3)以上物质中属于非电解质的是_________________(用序号)。
(4)从②溶液中得到氯化钠固体,应选择下列装置中的______________(填代表装置图的字母,下同);分离④与⑦的混合液,应选择下列装置中的________________。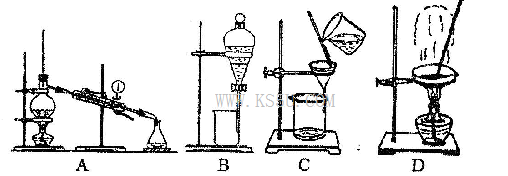
(5)请写出③和⑧中两种物质的溶液混合后发生反应的离子方程式:________________________________________________________________________.
(6)在标准状况下,__________L⑩与34. 2g⑥中含有相同的氧原子数。
(12分)几种短周期元素的原子半径及某些化合价见下表:
| 元素代号 |
A |
B |
D |
E |
G |
H |
I |
J |
| 化合价 |
–1 |
–2 |
+4、–4 |
+4、–2 |
+5、–3 |
+3 |
+2 |
+1 |
| 原子半径/nm |
0.071 |
0.074 |
0.077 |
0.102 |
0.110 |
0.143 |
0.160 |
0.186 |
分析上表中有关数据,并结合已学过的知识,回答以下问题。涉及上述元素的答案,请用元素符号表示。
(1)E元素在周期表中位于周期族;
(2)A、H、J对应的离子半径由大到小的顺序是(填写离子符号)
(3)J单质在B单质中燃烧可生成化合物X,X的电子式是,其中所含的化学键类型为。
(4)I单质可在D的最高价氧化物中燃烧,涉及的化学方程式为:。
(5)B与H所形成的化合物与J的最高价氧化物对应水化物Y的溶液发生反应的离子方程式为。
(12分)化合物A是一种重要的光化学试剂。A~H之间相互转化关系如下图所示:(部分反应物、生成物没有列出)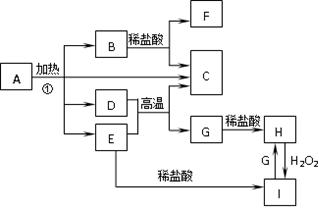
已知:化合物A中含二种阳离子和一种带二个单位负电荷的阴离子,三种离子的个数比为3∶1∶3。阴离子中各元素的质量分数与C相同且相对分子质量是C的2倍。C、D都为气体且含有元素种类相同,C能使澄清石灰水变浑浊,E是一种红棕色的颜料,F的焰色反应呈紫色,I能使KSCN溶液显红色。
回答下列问题:
(1)C的电子式为:;A的化学式为:。
(2)D+E→C+G的化学方程式:。
(3)H+H2O2+HCl→I的离子方程式:。
(4)在A的溶液中滴入酸性高锰酸钾溶液,高锰酸钾溶液紫色褪去,而在A的溶液中滴入硫氰化钾溶液,溶液呈红色。产生上述现象的主要原因是
_________________________________________________________________________。
(18分)下表是元素周期表中短周期元素的一部分,表中所列字母分别代表一种元素。
| A |
B |
||||||
| D |
E |
F |
|||||
| C |
G |
H |
(1)C的原子结构示意图为:__________________;
(2)A与G形成的化合物X的结构式为____________,其中X中含有的化学键是________
X属于_________化合物(填“离子”或“共价”)。
(3)比较非金属性强弱:G _____ H(填“>”或“<”),用一个化学方程式表示该强弱关系_____________________________________________________________________。
(4)在一定条件下,A与E可形成一种化合物X,其相对分子质量与O2相同,则X为______; X可在纯氧中燃烧,所得产物无污染,涉及的化学方程式为:_____________________。
(5)“神舟”六号载人飞船内需要用化合物X(由上表中的某2种元素组成)来吸收航天员呼出的CO2,请用化学方程式表示吸收原理:_______________________________。飞船中需要制造一种适合航天员生存的人工态环境,还应该在氧气中充入一种稀释气体,该气体为_______。
(6)E的气态氢化物与其最高价氧化物水化物反应的产物X在一定温度下分解,生成两种氧化物,每1 mol X分解时转移的电子为4 mol,X受热分解的化学方程式为_______
(12分)化学与人类社会可持续发展密切相关,能源、环境、材料以及日常生活等都离不开化学。
(1)乐山是国家级硅材料产业基地,硅材料是无机非金属材料的主角。请你举出两种含硅的材料名称 、 。用氢气在高温下还原SiCl4是高纯硅生产过程中的一个环节,写出该反应的化学方程式 。
(2)大量使用化石燃料,最直接的危害是造成“温室效应”、“酸雨”等环境问题。为了防治酸雨,降低煤燃烧时向大气排放的SO2,某硫酸工厂上使用石灰乳吸收尾气,涉及的化学方程式为:
(3)汽车尾气中的NO、CO已经成为许多城市空气的主要污染源。但汽车的燃料中一般不含氮元素,尾气中的NO从何而来?写出有关化学方程式;治理汽车尾气中NO和CO的一种方法是:在汽车排气管上装一个催化转化装置,使NO与CO反应,生成CO2和N2,写出反应的化学方程式。
电解原理在化学工业中有广泛应用。如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连。请回答以下问题:
(1)若X、Y都是惰性电极,a是NaCl溶液,实验开始时,同时在两边各滴入几滴酚酞试液,则:
① Y电极上的电极反应式为。
在X极附近观察到的现象是。
②电解总反应离子方程式为。
(2)要在铁件的表面镀铜防止铁被腐蚀,则:
① Y电极的材料是(选填纯铁、纯铜或纯锌),电极反应式是。电解液a选用溶液,电解过程中其浓度(选填增大、减小或不变)。
②若电镀前X、Y两电极的质量相同,电镀完成后将它们取出洗净、烘干、称量,二者质量差为5.12 g,则电镀时电路中通过的电子为mol。
③镀层破损后,镀铜铁比镀锌铁更容易被腐蚀,请简要说明原因:
。