在一定条件下,将3 mol A和1 mol B两种气体混合于固定容积为2 L的密闭容器中,发生如下反应:3A(g)+B(g)  xC(g)+2D(g), 2 min后该反应达到平衡,生成0.8 mol D,并测得C的浓度为0.2 mol·L-1。则下列判断正确的是
xC(g)+2D(g), 2 min后该反应达到平衡,生成0.8 mol D,并测得C的浓度为0.2 mol·L-1。则下列判断正确的是
| A.x=2 |
| B.2 min内A的反应速率为0.6 mol·L-1·min-1 |
| C.B的转化率为40% |
| D.若混合气体的密度不变,则表明该反应达到平衡状态 |
把金属钠投入到下列物质的溶液中,溶液质量减轻的是
| A.HCl | B.Na2SO4 | C.FeCl3 | D.CuSO4 |
下列物质既能与酸反应又能与碱反应的是
| A.Na2CO3 | B.NaOH | C.BaCl2 | D.NaHCO3 |
欲使每10个水分子中溶有1个钠离子,则90 mL水中应加入金属钠的质量大约是
| A.10.5 g | B.11.5 g | C.21 g | D.23 g |
戴·克汽车公司曾宣布,将于2012年正式销售氢燃料电池车。据报道,氢燃料电池公交汽车已经驶上北京街头。下列说法正确的是
| A.电解水制取氢气是理想而经济的制氢方法 |
| B.发展氢燃料电池汽车不需要安全高效的贮氢技术 |
| C.氢燃料电池汽车的使用可以有效减少城市空气污染 |
| D.氢燃料电池把氢气和氧气燃烧放出的热能转化为电能 |
在MnO2+ 4HCl(浓)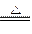 MnCl2+ Cl2↑+ 2H2O反应中,被氧化的HCl与参加反应的HCl质量关系是
MnCl2+ Cl2↑+ 2H2O反应中,被氧化的HCl与参加反应的HCl质量关系是
| A.两者质量相等 |
| B.后者是前者的3倍 |
| C.前者是后者的1/2 |
| D.前者是后者的1/4 |