过氧化氢溶液在二氧化锰的条件下能迅速分解成氧气和水。分液漏斗可以通过调节活塞控制液体滴加速度。回答下列问题:
(1)分液漏斗中应放入的物质是 ,锥形瓶中应放入的物质是 。
(2)要收集一瓶纯净的氧气应选择上图中的装置 (填字母)。
(3)某同学在观察到锥形瓶内有大量气泡时,开始用C装置收集氧气, 过一断时间后用带火星的木条伸入瓶口、瓶中、瓶底,都未见木条复燃。其可能原因是 。
(4)为检验装置B中氧气是否收集满,可用带火星的木条放在集气瓶的_______,这是利用了氧气_______________的性质。
(5)若实验时用此法代替高锰酸钾加热制氧气,优点是 (填序号)
A.生成物中只有氧气 B.不需加热 C.需加热
(6)装置A中反应剧烈,据此提出实验安全注意事项是 。
A.控制液体的滴加速度 B.用体积小的锥形瓶 C.加热反应物
如图A是碘元素在元素周期表中的信息,B~E是四种粒子的结构示意图。请回答。

(1)从A中可知,碘的相对原子质量为 。
(2)B~E四种粒子中:
①属于同种元素的是 (填字母,下同)。
②核外电子排布相同的是 。
③易得电子形成阴离子的是 。
我们的衣食住行都离不开化学。请回答下列问题。
(1)衣:同学们穿的运动服,其主要是涤纶,涤纶属于 (填“天然纤维”或“合成纤维”)。
(2)食;多吃柑橘、橙子,可以补充 (填“维生素A”或“维生素C”),预防坏血病。
(3)住:进入新装修的房间会闻到异味,体现粒子的 性质。人们会购买许多活性炭来除异味,这是利用其 性。
(4)行:外出旅游乘坐的飞机使用的航空煤油是由 (填1种化石燃料)炼制的产品。飞机的外壳主要是镁铝合金。这利用了镁铝合金的 (填字母)性质。
A.密度小、材质轻
B.导电性
C.抗腐蚀性能好
请用化学用语填空。
(1)氖元素 ;(2)镁原子 。
(3)小苏打 ;(4)2个过氧化氢分子 。
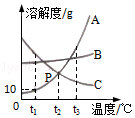
如图为A、B、C三种固体物质在水中的溶解度曲线,请回答下列问题.
(1)p点表示的含义是 .
(2)将t3℃时A物质的不饱和溶液变为该温度下的饱和溶液,可采取的方法是 (一种即可).
(3)将A、B、C三种物质的饱和溶液由t1℃升温到t2℃时,有晶体析出的是 .
(4)t1℃时,将15g A物质加入到50g水中,不断搅拌,充分溶解后,所得溶液的质量是 g.
(5)将t2℃时等质量的A、B、C三种物质的饱和溶液降温至t1℃时,所得溶液的质量由大到小的顺序是
.
小明的妈妈为小明准备了一份午餐:大米饭、红烧鲤鱼、溜豆腐、鸡蛋汤.请根据学过的知识回答下列问题.
(1)从营养均衡的角度考虑,他还应该增加的食物是 (写一种即可).
(2)在中午做汤时加入碘盐,其中的“碘”是指 (填“原子”、“分子”、“元素”或“物质”).
(3)饭后用洗洁精去餐具上的油污,是因为洗洁精具有 功能.
(4)饭后为了防止铁锅生锈,应采取的措施是 (写一条即可).