黄铁矿主要成分是FeS2。某硫酸厂在进行黄铁矿成分测定时,取0.1000 g样品在空气中充分灼烧,将生成的SO2气体与足量Fe2(SO4)3溶液完全反应后,用浓度为0.02000 mol/L的K2Cr2O7标准溶液滴定至终点,消耗K2Cr2O7溶液25.00 mL 。
已知:SO2 + 2Fe3+ + 2H2O→SO + 2Fe2+ + 4H+
+ 2Fe2+ + 4H+
Cr2O + 6 Fe2+ + 14 H+ →2 Cr3+ + 6 Fe3+ + 7 H2O
+ 6 Fe2+ + 14 H+ →2 Cr3+ + 6 Fe3+ + 7 H2O
(1)样品中FeS2的质量分数是(假设杂质不参加反应) 。
(2)若灼烧6 g FeS2产生的SO2全部转化为SO3气体时放出9.83 kJ热量,产生的SO3与水全部化合生成H2SO4,放出13.03kJ热量,写出SO3气体转化为H2SO4的热化学方程式: 。
(3)煅烧10 t上述黄铁矿,理论上产生SO2的体积(标准状况)为 ,制得98%的硫酸质量为 t ,SO2全部转化为H2SO4时放出的热量是 kJ。
(1)下列数据是对应物质的熔点(℃)
| NaCl |
Na2O |
AlF3 |
AlCl3 |
BCl3 |
Al2O3 |
CO2 |
SiO2 |
| 801 |
920 |
1291 |
190 |
-109 |
2073 |
-57 |
1723 |
据此作出的下列判断中,错误的是
A、铝的化合物晶体 中有离子晶体
中有离子晶体
B、表中只有BCl3、干冰是分子晶体
C、同族元素的氧化物可形成不同类型的晶体
D、不同族元素的氧化物可形成不同类型的晶体
(2)SiO2晶体结构片断如图所示。SiO2晶体中Si和Si-O键的比例为_____________。
通常人们把拆开1mol 某化学键所吸收的能量看成该化学键的键能。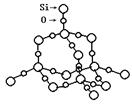
| 化学键 |
Si-O |
Si-Si |
O=O |
| 键能/ KJ·mol-1 |
460 |
176 |
498 |
Si(s)+O2(g) SiO2(s),该反应的反应热△H =" ___________"
SiO2(s),该反应的反应热△H =" ___________"
(1)下列物质在固态时,属于分子晶体的有,属于原子晶体的,属于离子晶体的有。①金刚石②氩③水 晶④水银⑤氧化铝⑥P4⑦苯
晶④水银⑤氧化铝⑥P4⑦苯
(2)比较下列物质的有关性质(用“>、<、=或≈”号连接)
沸点:16O218O2熔点:NaK稳定性:H2OD2O
(3)某常见固体能导电,质软,它可能属于__________
| A.分子晶体 | B.原子晶体 | C.离子晶体 | D.金属晶体E.混合晶体 |
(4)在氯化铯晶体(见图1)中,若以某一铯离子为球心,与之等距离的若干离子构成
一个球面。与某铯离子距离最近的离子构成的球面(最内层的球面或第一层球面)
上有个离子(填写离子符号,下同),第二层球面上有个
离子。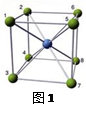
(5)在氯化钠晶体(见图2)中,每个钠离子与个最近且等距离的氯离
子以键相结合,与每个氯离子最近的且等距离的氯离子有个。
由于晶体中离子按一定的规律排列,必然造就了一颗完美晶体特定的几何外形,
其中,氯化钠单晶的 宏观外形为。
宏观外形为。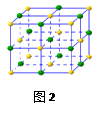
元素代 号 号 |
I1 |
I2 |
I3 |
I4 |
| Q |
2080 |
4000 |
6100 |
9400 |
| R |
500 |
4600 |
6900 |
9500 |
| S |
740 |
1500 |
7700 |
10500 |
| T |
580 |
1800 |
2700 |
11600 |
| U |
420 |
3100 |
4400 |
5900 |
有A、B、C、D、E 5种元素,它们的核电荷数依次增大,且都小于20。其中C、E是金属元素;A和E属同一族,它们原子的最外层电子排布为ns1。B和D也属同一族,它们原子最外层的p能级电子数是s能级电子数的两倍,C原子最外层上电子数等于D原子最外层上电子数的一半。请回答下列问题:
(1)A是________,B是________,E是_________。(请填写元素符号)
(2) 写出C元素基态原子的电子排布式_________________________。
(3) 用轨道表示式表示D元素原子的最外层电子构型____________________。
氮是地球上极为丰富的元素
(1)Li3N晶体中氮以N3-的形式存在,基态N3-的电子排布式为____________;
(2)X离子中所有电子正好充满K、L、M三个电子层,它与N3-形成的晶体结构如右图所示。X的元素符号是______,X离子与N3-形成的化合物化学式为______。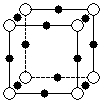
(3)水是生命之源,它与我们的生活密切相关。在化学实验和科学研究中,水也是一种常用的试剂。下列是钠、碘、金刚石、干冰、氯化钠晶体的晶胞图(未按顺序排序)。与冰的晶体类型相同的是_____(请用相应的编号填写)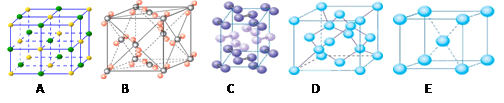
(4)在冰晶体中,每个水分子与相邻的4个水分子形成氢键,已知冰的升华热是51 kJ/mol,除氢键外,水分子间还存在范德华力(11 kJ/mol),则冰晶体中氢键的“键能”是_________kJ/mol;
用符号“>”“<”或“=”连接下列各项关系。
(1)第一电离能N______O;(2)电负性:N______C;
(3)键的极性:H-C______H-Si ;(4)键角:H2S______NH3
(5)分子中σ键数目:C6H6______C3H8;(6)分子中π键数目:C2H4______C2H2
(7)晶格能:MgO______KI(8)原子化热:Na ______K