在实验室中,氮氧化物废气(主要成分NO2和NO)可以用NaOH溶液来吸收,除去这些废气,其主要反应为:2NO2 +2 NaOH →NaNO2 + NaNO3 + H2O NO + NO2 + 2NaOH → 2NaNO2 + H2O
(1)2molNO和2.4molNO2混合气体通入NaOH溶液被完全吸收时,生成的NaNO2
是_______mol;生成的NaNO3是_______mol 。
(2)NO和NO2的混合气体的组成可表示为NOX ,该混合气体通入NaOH溶液被
完全吸收时,x的值可以为 (填编号)。
a.1.1 b.1.2 c.1.5 d.1.8
(3)若用纯碱溶液处理氮氧化物废气,反应与上述类似,同时放出CO2。
请写出纯碱溶液吸收NO2的化学方程式:____________________
(4)现有标准状况下a升NO2(其中N2O4体积分数为20%)和b升NO的混合气恰好被200mL Na2CO3溶液完全吸收,则a、b应满足的关系为: ;该Na2CO3溶液的物质的量浓度为 ________mol/L(用含a、b的代数式表示)。
(5)若在标准状况下,2.016 L氮氧化物的混合气和0.896LO2与1mol/LNa2CO3溶液50mL恰好反应生成NaNO3,则混和气体中N2O4与NO2的体积比为 。
(1)前三周期元素中第一电离能最小的是___________ (填元素符号),其基态原子的电子排布式为______________________。第二周期非金属元素形成的氢化物中化学键极性最大的是__________(填分子式)。
(2)物质形成分子间氢键和分子内氢键对物质性质的影响有显著差异。根据下表数据,形成分子间氢键的物质是___________ (填物质字母代号)。
| 代号 |
物质 |
结构简式 |
水中溶解度/g (25℃) |
熔点/℃ |
沸点/℃ |
| A |
邻—硝基苯酚 |
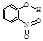 |
0.2 |
45 |
100 |
| B |
对—硝基苯酚 |
 |
1.7 |
114 |
295 |
(3)电负性的大小:C___________O,键能的大小:HBr___________HI。(填“>”、“=”或“<”)
氯化铬酰(CrO2Cl2)在有机合成中可作氧化剂或氯化剂,能与许多有机物反应。请回答下列问题:
⑴写出基态铬原子的外围轨道表示式_______________________________,与铬同周期的所有元素的基态原子中最外层电子数与铬原子相同的元素有____________(填元素符号),其中一种金属的晶胞结构如右图所示,该晶胞中含有金属原子的数目为________。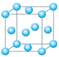
⑵CrO2Cl2常温下为深红色液体,能与CCl4、CS2等互溶,据此可判断CrO2Cl2是__________(填“极性”或“非极性”)分子。
⑶在①苯、②C2H4、③CCl4、④CO2五种有机溶剂中,碳原子采取sp2杂化的分子有___________(填序号),CO2分子的空间构型是______________。
、某芳香族化合物A的水溶液呈酸性,测得A分子中无酚羟基。A可发生下图所示转化,其中F为五元环状化合物;G可使溴的四氯化碳溶液褪色;F和G互为同分异构体;H和I都是医用高分子材料。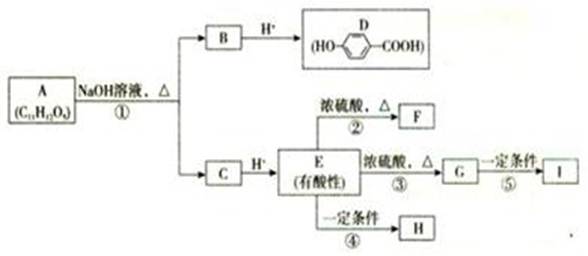
请回答:
(1)E中的官能团名称是羟基、 。
(2)③的反应类型是 。
(3)②的化学方程式是 。
(4)A与H的结构简式分别是 、 。
(5)D与足量X溶液反应后可得到C7H5O3Na,则X溶液中所含溶质的化学式是 。
(6)写出符合下列条件的G的同分异构体:
①能发生水解反应
②分子中不含环状结构
③核磁共振氢谱显示分子中有4种不同化学环境的氢原子
④能发生银镜反应,分子中有甲基
、A—J是中学化学常见的物质,它们之间的转化关系如下图所示(部分产物已略去)。已知A是一种高熔点物质,D是一种红棕色固体。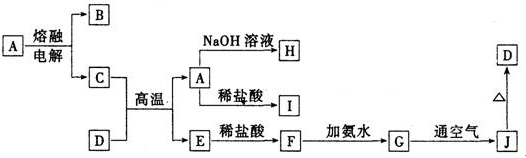
请回答下列问题:
(1)A物质的名称为___________,H与I反应所得难溶物化学式为 。
(2)C与D在高温下的反应在冶金工业上称为 反应
(3)写出G→J、J→D的化学方程式:___ 、 _
(4)A→H的离子方程式为___________________________________________
(5)用离子方程式表示I物质能用于净水的原理______________________
、短周期元素X、Y、Z、W、Q的原子序数依次增大,Y原子最外层电子数是次外层的2倍,X、W可分别与Z组成常见化合物X2Z、X2Z2、W2Z、W2Z2,Q的单质是常见的半导体材料。请回答:
(1)Y在元素周期表中的位置是 。
(2)X2Z的电子式是 。
(3)W2Z2与X2Z反应的化学方程式是 。
(4)上述元素中有两种非金属元素位于同一主族。能证明它们非金属性强弱的一个反应的化学方程式是 。
(5)在 25℃、101 kPa下,Q的气态氢化物在氧气中完全燃烧可得Q的最高价氧化物,反应中每转移1mol e-放热190.0 kJ。则该反应的热化学方程式是 。