如图表示10ml量筒中液面的位置,A与B,B与C刻度间相差1ml,如果刻度A为4,则量筒中液体的体积是( )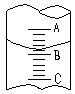
| A.4.8ml | B.3.2ml | C.3.20ml | D.4.80ml |
在一支25mL的酸式滴定管中盛入0.1mol/L HCl溶液,其液面恰好在5mL刻度处。若把滴定管内溶液全部放入烧杯中,再用0.1mol/L NaOH溶液进行中和,则所需NaOH溶液的体积
| A.大于20mL | B.小于20mL | C.等于20mL | D.等于5mL |
在城市中地下常埋有纵横交错的管道和输电线路,有些地面上还铺有地铁或城铁的铁轨,当有电流泄漏入潮湿的土壤中,并与金属管道或铁轨形成回路时,就会引起后者的腐蚀。原理简化如图所示。则下列有关说法不正确的是
| A.原理图可理解为两个串联电解装置 |
| B.溶液中铁丝被腐蚀时,左侧有无色气体产生,附近产生少量白色沉淀,随后变为灰绿色 |
| C.溶液中铁丝左端电极反应式为:Fe-2e-=Fe2+ |
| D.地下管线被腐蚀,不易发现,维修也不便,故应将埋在地下的金属管道表面涂绝缘膜(或油漆等) |
下列有机化合物的一氯代物种类最多的是(不考虑立体异构)
A. |
B. |
C. |
D. |
用一种阴、阳离子双隔膜三室电解槽处理废水中的NH4+,模拟装置如图所示。下列说法正确的是
| A.阳极室溶液由无色变成棕黄色 |
| B.阴极的电极反应式为:4OH–-4e–=2H2O+O2↑ |
| C.电解一段时间后,阴极室溶液中的pH升高 |
| D.电解一段时间后,阴极室溶液中的溶质一定是(NH4)3PO4 |
NA代表阿伏加德罗常数的值,下列说法正确的是
| A.常温常压,11.2 L NO和O2混合气体的原子数为NA |
| B.1.5 g甲基所含有的电子数目为0.9NA |
| C.1 L 0.1mol/L的氨水中含有的N原子数小于0.1NA |
| D.7.8g苯中碳碳双键的数目为0.3NA |