将2.3 g金属钠放入100 g水中,完全反应后溶质的质量分数为( )
A.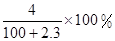 |
B.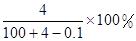 |
C. |
D. |
物质的量浓度相同的NaCl、MgCl2、AlCl3三种溶液,当溶液的体积比为3∶2∶1时,三种溶液中Cl— 的物质的量之比为
| A.1∶1∶1 | B.1∶2∶3 | C.3∶2∶1 | D.3∶4∶3 |
下列气体中,既能用浓硫酸干燥,又能用氢氧化钠干燥的是
| A.CO2 | B.N2 | C.SO2 | D.NH3 |
设NA表示阿伏加德罗常数,下列叙述中正确的是
| A.标准状况下,2.24 L CCl4所含的原子数为0.5 NA |
| B.100 mL 0.1 mol/L的NaCl溶液中,所含微粒总数为0.02 NA |
| C.1.7 g的OH-中含有的电子数为NA |
| D.78 g Na2O2与足量水反应转移电子数为2 NA |
下列离子方程式书写正确的是
| A.铝粉投入到NaOH溶液中:2Al+2OH-=2AlO2-+H2↑ |
| B.AlCl3溶液中加入足量的氨水:Al3++ 3OH-=Al(OH)3↓ |
| C.三氯化铁溶液中加入铁粉:Fe3++Fe=2Fe2+ |
| D.FeCl2溶液跟Cl2反应:2Fe2++Cl2=2Fe3++2Cl- |
下列物质或溶液不能与CO2反应的是
| A.Na2O2 | B.CaCl2溶液 | C.Na2SiO3溶液 | D.Na2CO3溶液 |