下列热化学方程式书写正确的是(△H的绝对值均为正确值)
| A.2NO2=O2+2NO△H=+116.2 kJ/mol(反应热) |
| B.S(s)+O2(g)=SO2(g)△H=-296.8 kJ/mol(反应热) |
| C.NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l)△H=+57.3 kJ/mol(中和热) |
| D.C2H5OH(l)+2O2(g)=2CO (g)+3H2O(g)△H=-801 kJ/mol(燃烧热) |
在2A+B 3C+4D中,下列表示该反应速率最快的是
3C+4D中,下列表示该反应速率最快的是
| A.vA=0.5mol·L-1·s-1 | B.vB=0.3mol·L-1·s-1 |
| C.vC=0.8mol·L-1·s-1 | D.vD=1.0mol·L-1·s-1 |
如下图所示,△H1=-393.5 kJ•mol-1,△H2=-395.4 kJ•mol-1,下列说法或表示式正确的是
| A.C(s,石墨)==C(s,金刚石) △H=" +1.9" kJ•mol-1 |
| B.石墨和金刚石的转化是物理变化 |
| C.金刚石的稳定性强于石墨 |
| D.1 mol石墨的总键能比1 mol金刚石的总键能小1.9 kJ |
使反应4NH3(g)+3O2(g) 2N2(g)+6H2O(g)在2L的密闭容器中进行,半分钟后N2的物质的量增加了0.6mol。此反应的平均反应速率可表示为
2N2(g)+6H2O(g)在2L的密闭容器中进行,半分钟后N2的物质的量增加了0.6mol。此反应的平均反应速率可表示为
| A.v(NH3)=0.02mol·L-1·s-1 | B.v(O2)=0.01mol·L-1·s-1 |
| C.v(N2)=0.02mol·L-1·s-1 | D.v(H2O)=0.02mol·L-1·s-1 |
25℃、101 kPa下,2g氢气燃烧生成液态水,放出285.8kJ热量,表示该反应的热化学方程式正确的是
A.2H2(g)+O2(g) ="=" 2H2O(1) △H= ―285.8kJ/mol |
| B.2H2(g)+ O2(g) ="=" 2H2O(1) △H= +571.6 kJ/mol |
| C.2H2(g)+O2(g) ="=" 2H2O(g) △H= ―571.6 kJ/mol |
D.H2(g)+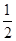 O2(g) ="=" H2O(1) △H= ―285.8kJ/mol O2(g) ="=" H2O(1) △H= ―285.8kJ/mol |
下列说法不正确的是
| A.化学反应除了生成新物质外,还伴随着能量的变化 |
| B.反应条件是加热的反应不一定是吸热反应 |
| C.放热反应的反应热总是大于吸热反应的反应热 |
| D.化学反应放热还是吸热,取决于生成物具有的总能量和反应物具有的总能量 |