常温下,pH=12的氢氧化钠溶液和pH=4的醋酸溶液等体积混合后恰好中和,忽略混合后溶液体积的变化,下列说法中正确的是
| A.混合前的醋酸约1%发生电离 |
| B.混合后的溶液中c(Na+)=c(CH3COO-) |
| C.氢氧化钠和醋酸的浓度不相等 |
| D.混合后的溶液呈中性 |
主族元素M、R形成的简单离子M2-离子与R+离子的核外电子数之和为20,下列说法正确的是
| A.M原子的质子数一定大于R原子的质子数 |
| B.M可能存在16M、18M两种核素 |
| C.M2-的离子与R+的电子层结构不可能相同 |
| D.两种离子结合形成的化合物中可能含有共价键 |
某有机物的结构简式如图所示,下列说法正确的是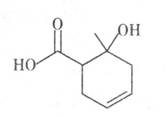
| A.可使溴的四氯化碳溶液或酸性KMnO4溶液褪色 |
| B.含有两种官能团 |
| C.与乙酸互为同系物 |
| D.可以发生取代反应和加成反应,但不能发生聚合反应 |
下列说法中,正确的是
| A.利用铁加入硫酸铜溶液中的反应可以比较Cu、Fe2+的还原性 |
| B.足量的铜跟一定量的浓硝酸反应只产生一种气体 |
| C.氮的固定只有在高温、高压、催化剂的条件下才能实现 |
| D.以铁为阴极、铜片为阳极、硫酸铜为电镀液可以实现铁制品镀铜 |
下列有关叙述不正确的是
| A.MgO、Al2O3熔点高,可用于制作耐火材料 |
| B.用浓氢氧化钠溶液可除去乙酸乙酯中混有的乙酸、乙醇杂质 |
| C.除去NaCl溶液中的Na2CO3,应选择试剂为盐酸,而不是硝酸 |
| D.油脂在碱性条件下易发生水解,可用于制作肥皂 |
化学与社会、生产、生活密切相关。下列说法正确的是
| A.碳纤维是一种新开发的材料,它属于合成有机高分子化合物 |
| B.对“地沟油”进行分馏可得到汽油 |
| C.漂白粉长期暴露在空气中最后会变质失效 |
| D.氯气溶于水生成次氯酸有强氧化性,可以起到除去水中杂质和杀菌消毒作用 |