氮元素可以形成多种分子和离子,如NH3、N2H4、N3-、NH4+、N2H62+等。回答以下问题:
(1)N的基态原子中,有 个运动状态不同的未成对电子。
(2)某元素原子与N3-含有相同的电子数,其基态原子的价电子排布式是_______。
(3)NH3、N2H4、NH4+、N2H62+四种微粒中,同种微粒间能形成氢键的有____________;不能作为配位体的有____________。
(4)纯叠氮酸HN3在常温下是一种液体,沸点较高,为308.8K,主要原因 是 。
(5)肼(N2H4)分子可视为NH3分子中的一个氢原子被—NH2(氨基)取代形成的另一种氮的氢化物。
①N2H4分子中氮原子的杂化类型是______。
②肼可用作火箭燃料,燃烧时发生的反应是:N2O4(l)+2N2H4(l)=3N2(g)+4H2O(g)
若该反应中有4 mol N—H键断裂,则形成的π键有________mol。
(6)肼能与硫酸反应生成N2H6SO4。N2H6SO4化合物类型与硫酸铵相同,则N2H6SO4内微粒间作用力不存在_______(填标号)
a.离子键 b.共价键 c.配位键 d.范德华力
镍镉(Ni-Cd)可充电电池在现代生活中有广泛应用。已知某镍镉电池的电解质溶液为
KOH溶液,其充、放电按下式进行:
.. Cd + 2NiOOH + 2H2O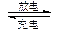 Cd(OH)2 + 2Ni(OH)2
Cd(OH)2 + 2Ni(OH)2
.. 有关该电池的说法正确的是()
| A.充电时阳极反应:Ni(OH)2-e— + OH- ="=" NiOOH + H2O |
| B.电池充电时,电池正极和电源的负极连接。 |
| C.放电时负极附近溶液的碱性不变 |
| D.放电时电解质溶液中的OH-向正极移动 |
某温度下,某容积恒定的密闭容器中发生如下可逆反应:
CO(g)+H2O(g)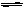 H2(g)+CO2(g)
H2(g)+CO2(g) H>0当反应达平衡时,测得容器中各物质均为n mol,欲使H2的平衡浓度增大一倍,在其它条件不变时,下列措施可采用的是()
H>0当反应达平衡时,测得容器中各物质均为n mol,欲使H2的平衡浓度增大一倍,在其它条件不变时,下列措施可采用的是()
| A.升温 | B.加催化剂 |
| C.再加入n molCO和n molH2O | D.再加入2n molCO2和2n molH2 |
某学生用质量为a g、边长为b cm的正方形镀锌铁片与过量盐酸反应测定镀层厚度,并将实验结果绘图示意,反应完毕后铁片质量为c g(已知锌的密度
为ρ g/cm3)。下列叙述错误的是()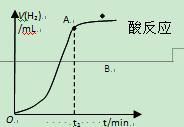
| A.t1时刻锌镀层已完全反应 |
| B.锌镀层的厚度为 |
| C.反应放热也是影响OA段的反应速率的因素之一 |
| D.有原电池反应发生,负极的电极反应式为Zn- 2e → Zn2+ |
高温下,某反应达到平衡,平衡常数K=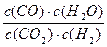 。恒容时,温度升高,H2浓度变大。下列说法正确的是()
。恒容时,温度升高,H2浓度变大。下列说法正确的是()
| A.该反应是焓变为负值 | |
B.恒温下,增大压强,H2浓度一定减小 |
C.升高温度,逆反应速率减小 |
| D.该反应化学方程式为CO+H2OCO2+H2 |
常温下,有甲、乙两份体积均为1 L、浓度均为0.1 mol/L的氨水,其pH为11。①甲用蒸馏水稀释100倍后,溶液的pH变为a;②乙与等体积、浓度为0.2 mol/L的盐酸混合,在混合溶液中:n(NH4+ )+n(H+)-n(OH-) =" b" mol。则a、b正确的答案组合是()
| A.9-11之间;0.1 | B.9-11之间;0.2 |
| C.12-13之间;0.2 | D.13;0.1 |