根据下列反应判断有关物质还原性由强到弱的顺序是
H2SO3+I2+H2O=2HI+H2SO4
2FeCl3+2HI=2FeCl2+2HCl+I2
3FeCl2+4HNO3=2FeCl3+NO↑+ 2H2O+Fe(NO3)3
| A.H2SO3>I->Fe2+>NO | B.I->Fe2+>H2SO3>NO |
| C.Fe2+>I->H2SO3>NO | D.NO>Fe2+>H2SO3>I- |
设NA为阿伏加德罗常数的值,下列叙述中正确的是
| A.1mol丙烷分子中,含有的非极性共价键数目为NA |
| B.标准状况下,1.8gH2O分子中所含有的电子数为NA |
| C.25℃时,pH=13的 Ba(OH)2溶液中含有的OH-数目为0.1 NA |
| D.2.24L氯气与过量的氢氧化钠溶液完全反应转移的电子数为0.1NA |
中学化学中,常见无机物A、B、C、D、E、X、Y存在如下图转化关系(部分生成物和反应条件略去)。
下列推断正确的是
A.若A是CaC2,X是H2O,则Y一定是溴水
B.若A是金属钠,X是H2O,则E一定能还原Fe2O3
C.若Y是NaOH,C是白色沉淀,则A与X一定发生置换反应
D.若Y是氧气,D是氧化物,则A与X一定发生氧化还原反应
下列有关实验装置的说法中正确的是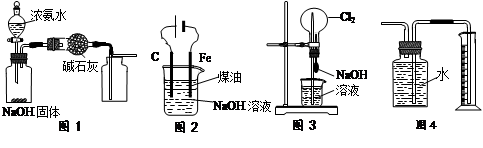
| A.用图1装置制取干燥纯净的NH3 |
| B.用图2装置实验室制备Fe(OH)2 |
| C.用图3装置可以完成“喷泉”实验 |
| D.用图4装置测量Cu与浓硝酸反应产生气体的体积 |
下列有关物质性质应用的说法正确的是
| A.SO2具有漂白性,可用作熏蒸粉丝使其增白 |
| B.常温下二氧化硅不与强酸反应,可用石英容器盛放氢氟酸 |
| C.铜的金属活泼性比铁的弱,可在铁船闸上装若干铜块以减缓其腐蚀 |
| D.氧化铝熔点很高,可用作制造高温耐火材料,如制耐火砖、坩埚等 |
常温下,下列各组离子在指定溶液中一定能大量共存的是
| A.使甲基橙变红色的溶液中:NO3-、SO42-、Fe2+、Na+ |
| B.强碱性溶液中:NH4+、NO3-、Ba2+、K+ |
| C.澄清透明的溶液中:MnO4-、Al3+、SO42-、K+ |
| D.含大量Fe3+的溶液中:Mg2+、Na+、Cl-、SCN- |