3.16 g KMnO4与50mL 12 mol·L-1过量浓盐酸完全反应(假设浓盐酸无挥发),化学方程式如下:2KMnO4+16HCl=2KCl+2MnCl 2+ 5Cl2↑+8H2O, 通过计算回答:
(1)未被氧化的HCl的物质的量是 ;
(2)产生的Cl2在标准状况下的体积为多少升?
(3)在反应后的溶液中加足量的AgNO3溶液可生成多少克沉淀?
将70 g Na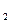 O
O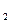 和Na
和Na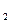 O的混合物跟98 g水充分反应后,所得氢氧化钠溶液的质量分数为50%。试通过计算推断原混合物中过氧化钠和氧化钠的质量各是多少。
O的混合物跟98 g水充分反应后,所得氢氧化钠溶液的质量分数为50%。试通过计算推断原混合物中过氧化钠和氧化钠的质量各是多少。
某种碱金属的过氧化物11 g与二氧化碳气体完全反应后,固体质量增加了2.8 g,试判断此碱金属的相对原子质量是多少,是什么金属。
室温下,氢氧化钠的溶解度为22 g,将多少克金属钠投入100 g水中,可获得该温度下的饱和溶液。
今有Na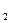 CO
CO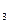 、NaHCO
、NaHCO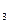 和NaCl的混合物100 g,加热到质量不再减少为止,其剩余残渣为84.5 g;将残渣溶于水,滴入足量AgNO
和NaCl的混合物100 g,加热到质量不再减少为止,其剩余残渣为84.5 g;将残渣溶于水,滴入足量AgNO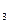 溶液得到白色沉淀,加足量稀硝酸后大部分沉淀消失,剩余沉淀为12.26 g。试计算混合物中Na
溶液得到白色沉淀,加足量稀硝酸后大部分沉淀消失,剩余沉淀为12.26 g。试计算混合物中Na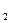 CO
CO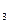 、NaHCO
、NaHCO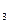 和NaCl的质量分数各是多少。
和NaCl的质量分数各是多少。
在120 ℃时,将12.4 g CO2和H2O(g)的混合气体缓缓通过过量的过氧化钠固体,充分反应之后,固体的质量增加6 g。
请计算:
(1)产生氧气的质量。
(2)原混合气体中CO2的质量。