为测定黄铜(锌铜合金)样品的组成,某同学取四个样品分别加稀硫酸做了四次实验,其实验数据记录如下表..
| 实验次数 |
l |
2 |
3 |
4 |
| 取样品质量(g) |
50.0 |
50.0 |
50.0 |
50.0 |
| 取稀硫酸质量(g) |
40.0 |
80.0 |
120.0 |
160.0 |
| 产生气体质量(g) |
0.4 |
0.8 |
1.0 |
1.0 |
(1)反应的化学方程式
(2)列出计算黄铜中参加反应的金属质量(X)的比例式:
(3)参加反应的稀硫酸的溶质质量分数
(4)向第一次实验所得溶液中加入47.4g水,溶液中溶质的质量分数
(5)若工业上用125t含Cu2S 70%的辉铜矿炼制该黄铜,理论上能炼制出黄铜的质量为 。
我校某班化学课外活动小组为测定我区某地石灰石中含碳酸钙的质量分数,取来了一些石灰石样品,准确称取样品10g放于烧杯中(杂质既不溶于水,也不与稀盐酸反应,也不分解),向其中加入足量的稀盐酸,根据实验测得的数据绘制右图。回答: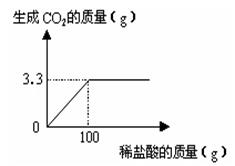
(1) 10g样品可以产生二氧化碳克。
(2) 该样品中碳酸钙的质量分数是多少。
未成年人和老年人是需要补钙的主要人群,目前市面上有许多补钙的钙片出售,如图是盖中盖高钙片的部分说明,某课外兴趣小组欲检验说明的真伪,进行了如下的实验:
盖中盖高钙片 【主要原料】碳酸钙、维生素D 【功效成分】每片含:钙500mg、维生素D100IU 【用法用量】每日1片,嚼食。 【适宜人群】需要补钙者。 【注意事项】 1、本品不能代替药物。 2、不宜超过推荐量或与同类营养素补充剂同时食用。 【规格】2.5g×36片 |
①取1片片剂研碎
②将其加入足量稀盐酸中
③完全反应后收集到0.55g二氧化碳
试分析:
(1)未成年人缺钙会得(填序号)
A.坏血症B.贫血
C.佝偻病 D.甲状腺肿大
(2)通过计算判断此钙片中钙含量与标注是否属实。(假定钙片中其他成份不与盐酸反应,1g=1000mg)
有铁粉和铜粉的均匀混合物,甲、乙、丙三位同学分别取该混合物与稀硫酸反应,所得数据如下表所示:
| 甲 |
乙 |
丙 |
|
| 取用金属混合物的质量/g |
10 |
10 |
20 |
| 取用稀硫酸的质量/g |
100 |
120 |
100 |
| 反应后过滤,得干燥固体的质量/g |
4 |
4 |
13 |
请分析数据,回答下列问题:
1)金属混合物中Cu的质量分数
2)计算丙同学所得溶液中溶质的质量分数(计算结果精确到0.1%)
网上报道某公司非法使用草甘膦转基因大豆。草甘膦的化学式(C3H8NO5P)是一种有机磷除草剂,白色晶体,易溶于水、乙醇等,不可燃,常温下稳定。计算;
1)一个草甘膦分子中含有的原子个数为
2)草甘膦中元素的质量比为C:H:O:N:P
3)33.8克草甘膦中含有多少克磷元素?(写出计算步骤,计算结果精确到0.1g)
某钢铁厂每天消耗4000t含Fe2O380%的赤铁矿石,该钢铁厂理论上可日产含Fe98%的生铁质量是多少?(计算结果保留到0.1)