某课外活动小组通过Internet网上资料得知: 废弃的定影液中含有一定量的AgNO3。他们从摄影店收集到一些废弃的定影液,准备将其中的银以单质的形式全部回收。于是进行了以下的实验活动。
(1)[设计方案]:①加入比银活泼的金属单质 ② 除去金属混合物中的杂质
(2)[小组讨论]:
①加入的金属:向定影液中加入过量铁粉,则得到的金属混合物中含银和铁。
②在这种方案中除去银粉中过量金属的方法:向金属混合物中加入适量的试剂_______。
(3)[进行试验]过程如下:
①废弃的定影液 金属混合物+溶液A
金属混合物+溶液A
②金属混合物 单质银
单质银
请问操作a是________,需要用到的玻璃仪器有:烧杯、玻璃棒、________;
(4)[产品验证]:请你设计一种简单方法验证得到的银中是否还含有铁粉,方法是 ____ 。
某化学实验小组欲探究盐酸、氢氧化钙的化学性质,取8支试管分别用A﹣H编号后,做如下实验.
(1)实验中观察到有气泡出现的试管是,有沉淀生成的试管是.
(2)写出实验中无明显现象产生的试管中发生的化学方程式 .
(3)实验后某试管中为红色溶液,当向其中加入过量的后,溶液变为蓝色.由此推断,该试管中最初盛有的物质是.
(4)实验后某试管的底部有白色固体,过滤后向滤液中滴加盐酸,一段时间后有气泡冒出,则该滤液中的溶质是.
(1)水煤气是将水蒸气通过灼热的焦炭而生成的气体,主要成分是一氧化碳、氢气及少量的二氧化碳和水蒸气.某课题组同学为验证水煤气的成分,做了以下准备:
(一)资料收集:①
②
.
③无水硫酸铜遇水由白色变为蓝色
(二)设计实验装置
请分析上面信息后回答:
①你认为验证水煤气中各成分的顺序依次是;
②装置C的目的是,装置D的作用是;
③装置E内观察到的现象是;
④实验中两次用到装置A,其目的分别是,;
请你设计一种尾气处理方案:.
(2)(4分)不少家庭养观赏鱼,有时会在鱼缸里放点"鱼浮灵",可使水中的含氧量迅速增加, "鱼浮灵"的化学名称是过氧碳酸钠(俗称固体双氧水,化学式2Na2CO3·3 H2O2).常温下, 过氧碳酸钠易溶于水并迅速放出氧气,能有效地提高水生动物的成活率.
①请设计实验验证"鱼浮灵"的供氧原理:
| 实验操作 |
现象 |
结论 |
②为证明"鱼浮灵"供氧后所得溶液的主要成分,还应补充实验:.
化学兴趣小组同学发现实验台上按如下顺序摆放着7瓶不同的无色溶液(如图所示),其中4、5号试剂瓶标签破损.
【提出问题】这两瓶试剂分别是什么
【查阅资料】
①碱性的亚硫酸钠
溶液、
溶液都能与中性的
溶液发生复分解反应,产生白色沉淀.
②
.
③
与
均可以使澄清石灰水变浑浊,
是一种有刺激性气味的气体.
【作出猜想】4、5号溶液可能分别是
或
溶液中的一种.
【实施方案】取少量4、5号溶液分别于试管中,然后分别进行下列三组实验.
实验1:在两支试管中分别滴入上述七种溶液中的号溶液,两试管中的溶液均变成红色,说明4、5号溶液均不可能是上述猜想中的溶液.
实验2:在两支试管中分别滴入上述七种溶液中的3号溶液,两试管中均产生白色沉淀,4、5号溶液可能分别是
溶液和
溶液中的一种.写出其中一个反应的化学方程式.
实验3:在两支试管中分别滴入上述七种溶液中的2号溶液,在盛4号溶液的试管中有现象,说明4号是
溶液;在盛5号溶液的试管中有
现象,说明5号是
溶液.
【实验反思】同学们经过分析,认为4号溶液还可能是变质的
溶液.请你利用上述图中的试剂设计鉴定实验方案,完成实验报告.
| 实验操作 |
实验现象 |
实验结论 |
|
|
|
4号溶液是部分变质的
溶液. |
小明同学想研究一氧化碳的还原性,通过查阅资料知道:草酸(H2C2O4)与浓硫酸混合加热会产生一氧化碳,反应方程式为:
。
于是他设计了下图的实验装置,结合装置回答下列问题: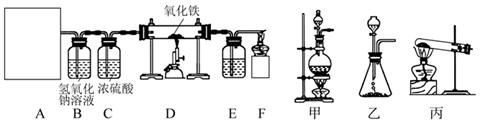
(1)图A是用草酸制取CO的反应装置,你认为应选择(填"甲"、"乙"或"丙")装置;(2)装置C的作用是;
(3)装置D中反应的化学方程式为;
(4)为检验装置D中产生的气体,E装置中的液体应为;
(5)装置F中酒精灯的作用是。
某化学兴趣小组的同学用下图所示装置进行实验(装置气密性良好),先关闭止水夹,将足量的氢氧化钠溶液滴入烧瓶中,充分吸收掉二氧化碳后,再打开止水夹。
(1)烧瓶中观察到的现象是。
(2)根据上述现象能否得出"二氧化碳与氢氧化钠发生了反应"的结论?原因是。
(3)实验结束后,兴趣小组提出新问题:烧瓶内液体的溶质可能是什么?
【猜想】猜想①:溶质只有氢氧化钠;
猜想②:溶质是氢氧化钠和氢氧化钙;
你还需补充的猜想:溶质是。
【设计实验】请你为这三种猜想设计实验验证方案
| 实验操作 |
预期现象及结论 |