可逆反应N2O4 2NO2△H>0在密闭容器中反应,达到平衡状态,要使混合气体颜色加深,可采取的方法是 ①减小压强 ②缩小体积③升高温度④增大N2O4的浓度 ( )
2NO2△H>0在密闭容器中反应,达到平衡状态,要使混合气体颜色加深,可采取的方法是 ①减小压强 ②缩小体积③升高温度④增大N2O4的浓度 ( )
| A.②③④ | B.①②③ | C.①③④ | D.①②③④ |
X、Y、Z三种元素的原子,其最外层电子排布分别是ns1、3s23p1和2s22p4,由这三种元素组成的化合物的化学式可能是
| A.XYZ2 | B.X2YZ3 | C.X2YZ2 | D.XYZ3 |
下列有关物质结构的表述正确的是
A.次氯酸的电子式 |
B.钠离子的结构示意图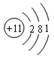 |
| C.硫原子的最外层电子排布式3s23p4 |
| D.二氧化硅的分子式SiO2 |
范德华力为a KJ·mol-1,化学键为b KJ·mol-1,氢键为c KJ·mol-1,则a、b、c的大小关系正确的是
| A.a>b>c | B.b>a>c | C.c>b>a | D.b>c>a |
因为镁、锂在元素周期表中具有特殊的“对角线”位置关系而性质相似,如它们的单质在过量氧气中燃烧均只生成正常氧化物等。以下叙述中正确的是
| A.Li2SO4难溶于水 |
| B.LiOH是可溶于水,受热不分解的强碱 |
| C.Li单质遇浓H2SO4不会产生“钝化现象” |
| D.Li2CO3受热分解生成Li2O和CO2 |
下列关于糖类的说法中正确的是
| A.葡萄糖不能发生水解反应,是最简单的醛糖 |
| B.淀粉可用于制备葡萄糖、酿制食醋、酿酒 |
| C.蔗糖是最甜的糖 |
| D.葡萄糖是醛糖具有还原性;果糖是酮糖,在碱性条件下不能发生银镜反应 |