50 mL 0.50 mol·L-1盐酸与50 mL 0.55 mol·L-1NaOH溶液在图示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。回答下列问题: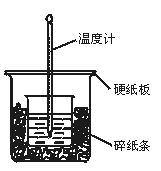
(1)从实验装置上看,图中尚缺少的一种玻璃用品是 。
(2)烧杯间填满碎纸条的作用是 。
(3)大烧杯上如不盖硬纸板,求得的中和热数值 (填“偏大”“偏小”“无影响”)。
(4)实验中改用60 mL 0.50 mol·L-1盐酸跟50 mL 0.55 mol·L-1NaOH溶液进行反应,与上述实验相比,所放出的热量 (填“相等”“不相等”),所求中和热 (填“相等”“不相等”),简述理由: 。
某同学对铜与浓硫酸反应产生的黑色沉淀进行探究,实验步骤如下:
Ⅰ.将光亮铜丝插入浓硫酸,加热;
Ⅱ.待产生黑色沉淀和气体时,抽出铜丝,停止加热;
Ⅲ.冷却后,从反应后的混合物中分离出黑色沉淀,洗净、干燥备用。
查阅文献:检验微量Cu2+的方法是:向试液中滴加K4[Fe(CN)6] 溶液,若产生红
褐色沉淀,证明有Cu2+。
(1)该同学假设黑色沉淀是CuO。检验过程如下:
①将CuO放入稀硫酸中,一段时间后,再滴加K4[Fe(CN)6] 溶液,产生红褐色沉淀。
②将黑色沉淀放入稀硫酸中,一段时间后,再滴加K4[Fe(CN)6] 溶液,未见红褐色沉淀。由该检验过程所得结论是_______________。
(2)再次假设,黑色沉淀是铜的硫化物。实验如下:
| 实验装置 |
现象 |
 |
1. A试管中黑色沉淀逐渐溶解 2. A试管内上方出现红棕色气体 3. B试管中出现白色沉淀 |
①现象2说明黑色沉淀具有______性。
②能确认黑色沉淀中含有S元素的现象是_________,相应的离子方程式是_____________。
③为确认黑色沉淀是“铜的硫化物”,还需进行的实验操作是___________________。
(3)以上实验说明,黑色沉淀中存在铜的硫化物。进一步实验后证明黑色沉淀是CuS与Cu2S的混合物。将黑色沉淀放入浓硫酸中加热一段时间后,沉淀溶解,其中CuS溶解的化学方程式是_____________。
苯甲酸及其钠盐可用作乳胶、牙膏、果酱或其它食品的抑菌剂,也可广泛应用于制药和化工行业,某同学尝试用甲苯的氧化反应制备苯甲酸,制备流程为:
操作步骤如下:① 将一定量的甲苯和碱性KMnO4溶液加热至沸腾,并冷凝回流至混合液不再分层。② 反应停止后,将反应混合液过滤,滤渣为黑色固体;得到的滤液如果呈紫色,可加入少量的饱和亚硫酸钠溶液使紫色褪去,重新过滤。③ 将②中所得滤液经一系列操作得到苯甲酸晶体。
已知:苯甲酸相对分子质量122,熔点122.4℃,在25℃和95℃时溶解度分别为0.3g和6.9g;
(1)该实验合成苯甲酸钾可能用到的下列仪器有__________。
A.圆底烧瓶B.蒸馏烧瓶 C.冷凝管D.温度计
(2)第①步中被回流的主要物质是____________________。
(3)写出滴加饱和亚硫酸钠溶液时的离子方程式______________________________。
(4)步骤③得到苯甲酸晶体应进行操作是________(按操作顺序填正确答案序号)。
A.酸化 B.过滤 C.蒸发浓缩D.冷却结晶
实验室中,用硫铁矿烧渣(主要成分为Fe2O3、FeO、SiO2等)为原料制备高纯氧化铁(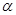 —
—
Fe2O3)的步骤如下:
回答下列问题:
(1)上述实验中,加入铁粉的作用是____________。(用离子方程式表示)实验中检验溶液x中的离子是否与铁粉完全反应的试剂是____________溶液
(2)实验室欲用18.4 mol·L-1。的浓硫酸配制100 mL5.0mol·L-1的硫酸溶液,所用仪器除胶头滴管、量筒、烧杯、玻璃棒外,还有_________(填写仪器名称);
(3)某同学用下图所示装置实现向溶液Y中通入NH3和CO2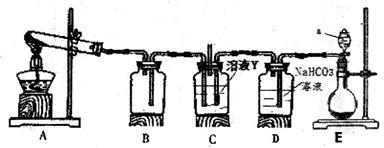
①上述装置的中,仪器a的名称是_______;装置B的作用是____________________。
②圆底烧瓶内放置的固体药品为________(填化学式);试管内发生反应的化学方程式为_________________。
③甲、乙、丙三位同学分别用上述装置进行实验,装置C的试剂瓶内溶液体积相等。
若甲、乙两同学实验中,通入的NH3和CO2的物质的量之比分别为2:l和l:l,恰好完全反应后,溶液中水的电离程度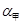 ________(填“>”“=”或“<”)
________(填“>”“=”或“<”)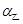 。
。
若丙同学未用装置D,则反应后溶液中离子浓度间的关系为[H+]+[NH4+]=_______。
(12分)金属单质及其化合物在生产生活中应用非常广泛,废旧金属的回收利用是重要研究课题。某学习小组在实验室中模拟利用含铜废料(主要成分为Cu和CuO,还有少量的A1,Fe及其氧化物)生产胆矾,其实验方案如下:
(1)上述流程中,操作1所得“滤液’‘的主要成分为_____________;
(2)酸溶后所得溶液中的榕质主要有_____________;
(3)请写出酸溶过程单质铜发生反应的离子方程式___________;该反应中氧化剂与还原剂的物质的量之比为______________;
(4)试剂可以是________________;
(5)操作3是一系列操作.其操作为______________、冷却结晶、过滤、___________、小心干燥。
(12分)氯气是一种重要的工业原料。
(1)实验室可用高锰酸钾和浓盐酸反应制取氯气,反应的化学方程式是:__________________。
(2)资料显示:
某学习小组利用此原理设计如图所示装置制取氯气并探究其性质。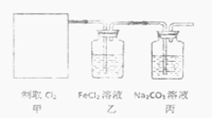
①在该实验中,甲部分的装置是______(填字母)。如何检查该装置的气密性?_________________。
②乙装置中FeCl2溶液与Cl2反应的离子方程式是_______________。
③丙装置中通入少量Cl2,可制得某种生活中常用的漂白、消毒的物质。已知碳酸的酸性强于次氯酸。则丙中发生反应的化学方程式是____________。
④该实验存在明显的缺陷.改进的方法是_______________________________________________。